南京林大黄申林/郑煜团队: 首次报道有机催化光电化学半频哪醇重排缩环转化
- 2026-02-04 09:33:34

研究介绍
传统的半频哪醇重排反应是通过亲电试剂对烯丙醇的双键进攻产生亲电性碳正离子,引发重排反应生成相应的羰基化合物。 另一种策略是通过自由基加成到双键形成碳中心自由基,再进一步氧化为碳正离子中间体,从而引发半频哪醇重排。
研究内容
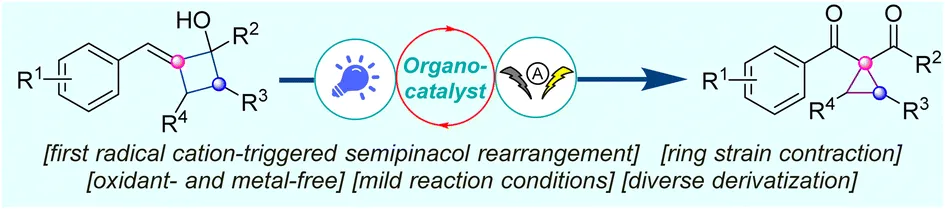
近日,南京林业大学黄申林/郑煜团队首次报道了有机催化光电化学环收缩反应。该反应通过烯烃自由基阳离子引发的半频哪醇重排成功实现了芳亚甲基环丁醇向高价值 1,1-环丙烷甲酰酮和二酮的高效转化。这一方法不仅条件温和、环境友好,更为药物中间体合成提供了全新思路!
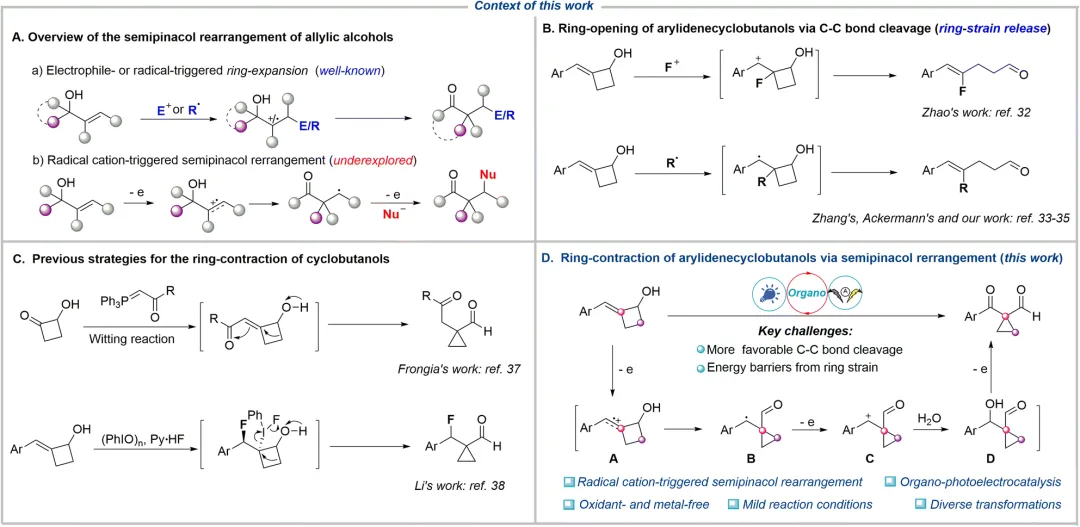
研究以 2-苄亚甲基环丁醇为模型底物,通过系统优化得到最佳反应条件:以 5 mol% [Mes-Acr⁺]ClO4- 为有机催化剂,nBu4NPF6 为电解质,Pt 电极为电极材料,在 CH3CN/H2O (5:1.2) 混合溶剂中,5 mA 恒电流、40 W 蓝光照射 6 小时,目标产物 1-苯甲酰 -1-甲酰环丙烷的分离产率达 72%。
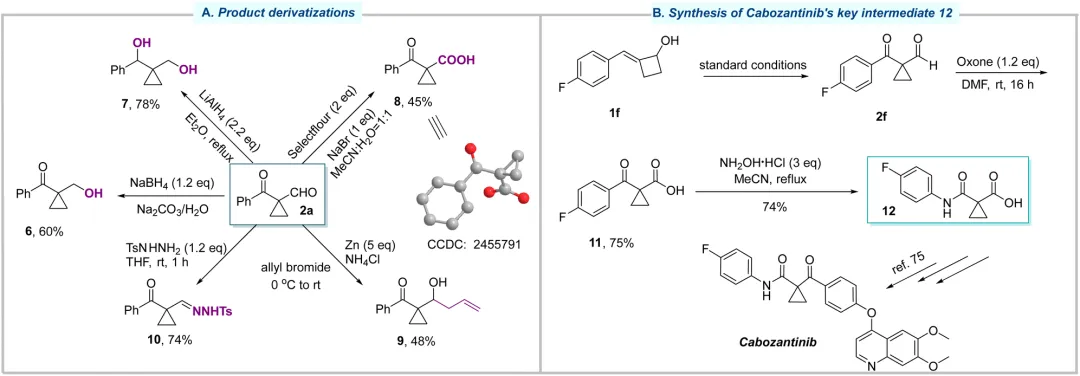
在最优条件下,该反应展现出良好的底物适用性。芳环对位、间位、邻位无论带有给电子基 (-Me, -tBu, -OMe, -Ph) 还是吸电子基(-F, -Cl, -Br, -CO₂Et),均能顺利反应。双取代衍生物、萘环、噻吩等杂环底物以及叔醇底物均能兼容。此方法还能应用于 L-薄荷醇、(+)-异蒲勒醇和(-)-冰片等天然产物衍生物的后期修饰,展现了其在复杂分子合成中的潜力。产物上的醛基提供了多样化的反应位点,可以发生氧化、还原、烯丙基化等一系列转化。值得一提的是,产物 2f 经氧化和贝克曼重排反应可高效制备合成抗癌药物卡博替尼的关键中间体。该路径避免了传统方法中腐蚀性试剂 SOCl₂ 的使用,凸显了该方法潜在的实用性。
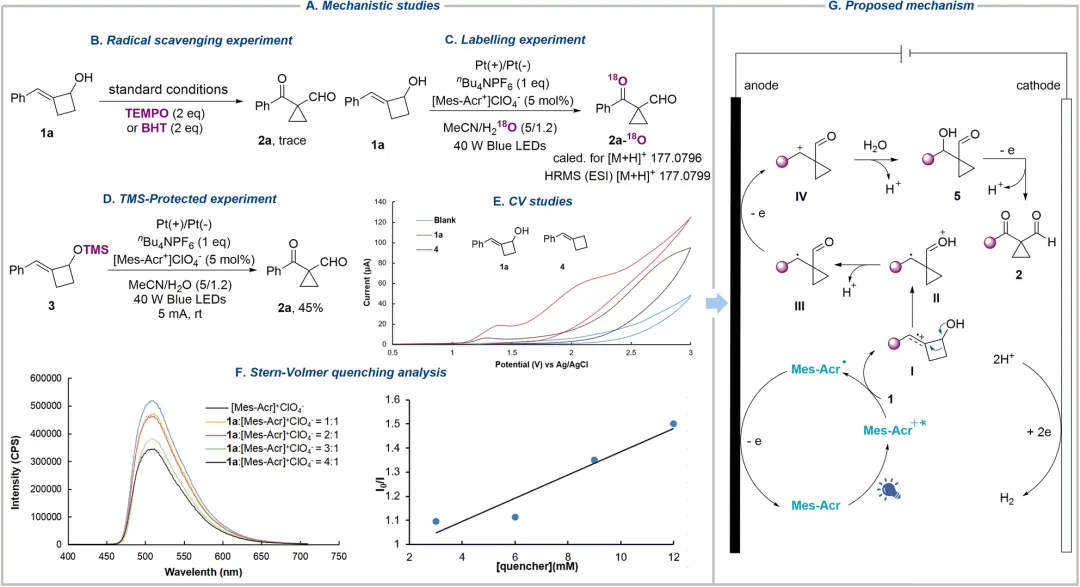
机理实验表明,自由基捕获剂 (TEMPO、BHT) 的加入会显著抑制反应。使用 H218O 进行的同位素标记实验证实产物中的氧原子来源于水。通过使用 TMS 保护的底物进行实验,排除了烷氧自由基途径的可能性。循环伏安法和荧光淬灭实验表明,反应优先氧化底物的 C=C 键,并由激发态的光催化剂完成这一氧化过程。基于上述结果,作者提出了可能的反应机理:激发态光催化剂氧化烯烃生成自由基阳离子 I,其经历半频哪醇型重排产生氧鎓离子 II,随后去质子化形成碳中心自由基 III,III 被进一步氧化为碳正离子 IV,水分子作为亲核试剂进攻得到中间体 5,最终经第三次阳极氧化生成产物 2。
该成果以“Organo-catalyzed photoelectrochemical ring-contraction of arylidenecyclobutanols via radical cation-triggered semipinacol rearrangement” (《光电催化自由基阳离子引发的半频哪醇重排实现环丁醇的缩环反应》) 为题,发表在英国皇家化学会旗舰期刊 Chemical Science#ChemSci 上。

论文信息
Organo-catalyzed photoelectrochemical ring-contraction of arylidenecyclobutanols via radical cation-triggered semipinacol rearrangement Yu Zheng,* Chunxi Chen, Xuhao Zhou, Guoyang Deng, Yanju Lu and Shenlin Huang* Chem. Sci., 2026, 17, 2295-2301 https://doi.org/10.1039/D5SC07637D
作者简介
郑煜
本文第一作者兼通讯作者,南京林业大学化学工程学院副教授,硕士生导师。主要从事绿色光电合成方法的开发以及手性稀土配合物的合成及性能研究。近年来,相关研究成果在国际重要学术期刊上共发表 SCI 论文 50 余篇。主持中国博士后科学基金面上项目、国家自然科学基金青年科学基金项目等 4 项。
期刊简介


rsc.li/chemical-science
Chem. Sci.
| 7.5分 | |
| 7.9分 | |
| Q1 | |
| 12.6分 | |
| 33 |
Chemical Science 是涵盖化学科学各领域的跨学科综合性期刊,也是英国皇家化学会的旗舰期刊。所发表的论文不仅要在相应的领域内具有重大意义,而且还应能引起化学科学其它领域的读者的广泛兴趣。所发表的论文应包含重大进展、概念上的创新与进步或者是对领域发展的真知灼见。发文范围包括但不限于有机化学、无机化学、物理化学、材料科学、纳米科学、催化、化学生物学、分析化学、超分子化学、理论化学、计算化学、绿色化学、能源与环境化学等。作为一本钻石开放获取的期刊,读者可以免费获取所发表论文的全文,同时从该刊的论文版面费由英国皇家化学会承担,论文作者无需付费。
Editor-in-Chief
Andrew Cooper🇬🇧 利物浦大学
Associate editors
|
|
† CiteScore 2024 by Elsevier
‡ 中位数,仅统计进入同行评审阶段的稿件


↓↓↓
