南京中医药大学医学院 | 破解结核分枝杆菌致病关键!PhoP 蛋白双重转录调控机制的冷冻电镜新发现
- 2026-02-13 21:06:45

1.研究背景
结核分枝杆菌(Mtb)是结核病的致病菌,全球近三分之一人口受其感染,每年约 200 万人死亡,亟需挖掘新的致病机制与治疗靶点。OmpR/PhoB 家族响应调节子 PhoP 作为 Mtb 的全局转录调控因子,可激活或抑制 100 余个与毒力、脂质合成、碳代谢及应激适应相关的基因,在细菌致病性和环境适应中起关键作用。其既能响应磷酸盐饥饿激活磷同化基因转录,又能通过与氮代谢全局调控因子 GlnR 交叉对话抑制氮代谢基因表达,但这种双重转录调控的分子机制尚未明确。此前研究已证实 PhoP 通过磷酸化增强 DNA 结合能力,识别 PHO 盒启动子,但多 PHO 盒启动子的调控模式及抑制机制的结构基础仍缺乏解析,限制了对该家族调控因子作用模式的理解及相关药物研发。
2.研究设计
蛋白与核酸制备:构建 pET28a-phop 等表达载体,在大肠杆菌中表达纯化 Mtb PhoP、PhoR、GlnR 及 RNAP 全酶,通过定点突变获得 PhoP 突变体;设计含不同 PHO 盒数量的启动子(pstS、phoU4、phoU6)及 PhoP-GlnR 交叉调控启动子 amtB,退火合成 DNA 支架。
复合物组装:将磷酸化的 PhoP 与 RNAP、不同 DNA 支架按比例孵育,组装 2PhoP-TAC、4PhoP-TAC、6PhoP-TAC 及 PhoP-TRC 复合物,经凝胶过滤层析纯化。
结构解析:采用冷冻电镜技术,通过 K3 Summit 探测器收集数据,利用 RELION 4.1 和 CryoSPARC v4.2 软件进行数据处理、颗粒筛选、3D 分类与重构,结合 Chimera 和 Coot 软件进行模型搭建与精修。
功能验证:通过体外转录实验检测 PhoP 及突变体对目标启动子的转录活性,利用凝胶迁移实验(EMSA)验证复合物特异性结合,通过定点突变分析关键残基及结构域的功能。
3.结果解读
复合物结构特征:成功获得 RPo(3.63 Å)、2PhoP-TAC(3.46 Å)、4PhoP-TAC(3.70 Å)、6PhoP-TAC(3.31 Å)及 PhoP-TRC(3.68 Å)的冷冻电镜结构,明确各复合物中 PhoP、RNAP、GlnR 与 DNA 的结合模式。
转录激活机制:PhoP 以串联二聚体形式协同结合启动子 PHO 盒,下游二聚体插入 - 35 元件区域的 DNA 大沟,取代 σAR4 与 - 35 元件的经典相互作用;同时 PhoP 通过 DBD 结构域与 RNAP 的 β flap、σAR4 及 αCTD 形成蛋白 - 蛋白相互作用,稳定 TAC 结构,6PhoP-TAC 中 αCTD 的参与进一步增强复合物稳定性,呈现 σ 适应型激活模式。
转录抑制机制:PhoP 二聚体竞争性结合 amtB 启动子上游 PHO 盒,导致 DNA spacer 区域扭曲,形成空间位阻阻碍第三个 GlnR 二聚体结合;同时 PhoP 与 GlnR、RNAP αCTD 存在相互作用,稳定抑制复合物,通过 “竞争性遮挡模型” 抑制 GlnR 依赖的转录。
关键残基功能:PhoP 的 E161、E164 等参与 DNA 结合及二聚化的残基突变,或 T191、K197 等参与 RNAP 相互作用的残基突变,均显著降低转录激活活性;减毒菌株中 PhoP 的 S219L 突变破坏 DNA 结合能力,导致转录活性下降。
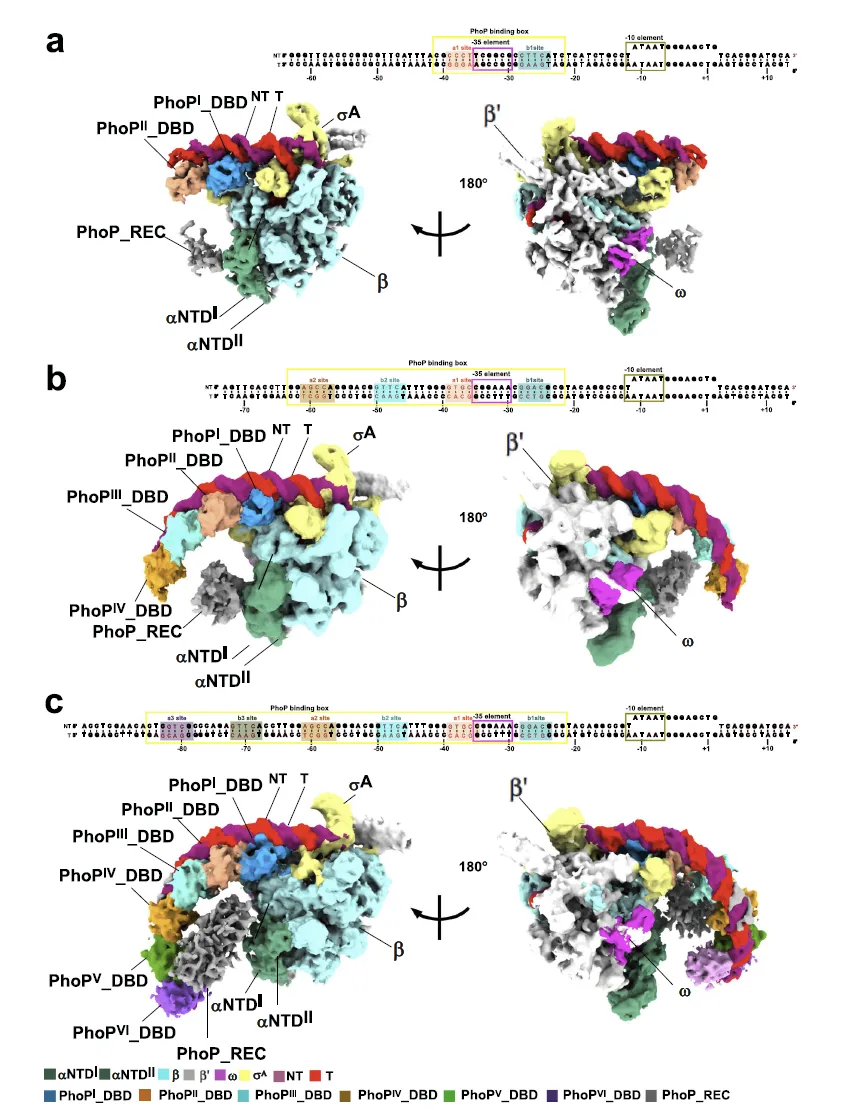
图 1:Mtb PhoP-TAC 的整体结构与 DNA 支架设计
该图清晰呈现了三种不同 PhoP 分子数量的转录激活复合物(2PhoP-TAC、4PhoP-TAC、6PhoP-TAC)对应的 DNA 支架结构及冷冻电镜密度图。DNA 支架设计上,pstS 含 1 个 PHO 盒(a1、b1 位点与 - 35 元件重叠),phoU4 含 2 个 PHO 盒(上游 a2-b2 位点和下游 a1-b1 位点),phoU6 通过延伸 phoU4 支架增加 27 bp,形成含 3 个 PHO 盒(上游 a3-b3、中间 a2-b2、下游 a1-b1 位点)的结构,且所有支架下游均包含保守 - 10 元件、转录泡和双链 DNA 片段。冷冻电镜密度图则直观展示了各复合物中 PhoP、RNAP 与 DNA 的组装模式,不同颜色标注的 PHO 盒、-35 元件、-10 元件及 PhoP 结合位点,为后续分析 PhoP 与启动子的相互作用提供了结构基础,印证了 PhoP 可通过识别不同数量的 PHO 盒形成多样化复合物。
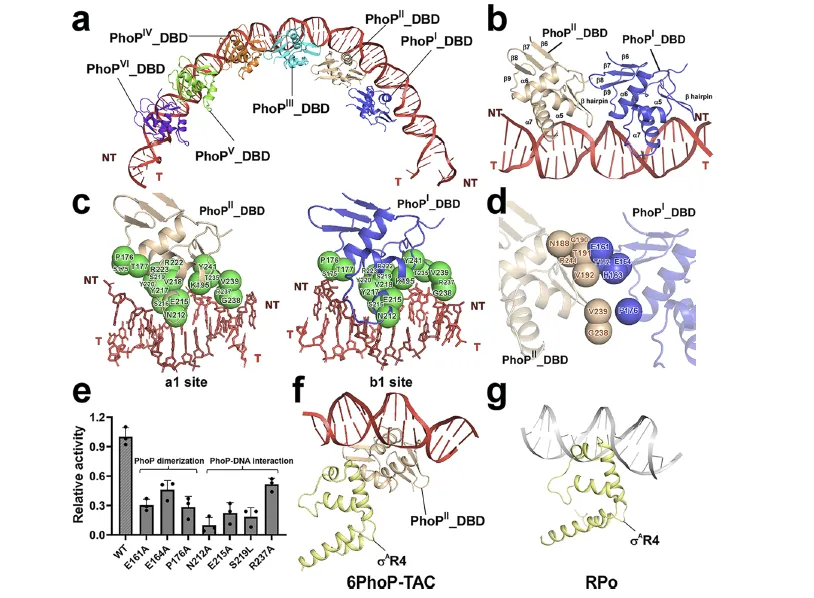
图 2:6PhoP-TAC 中串联 PhoP 六聚体与启动子 DNA 的结合模式及关键残基功能
该图聚焦 6PhoP-TAC,详细解析了 PhoP 六聚体与启动子 DNA 的相互作用及关键残基的功能。结构显示,PhoP 的六个 DBD 结构域(PhoPI-DBD 至 PhoPVI-DBD)有序结合在上游双链 DNA 上,其中 PhoPI-DBD 与 PhoPII-DBD 形成头尾二聚体,通过 α7 螺旋插入 DNA 大沟识别碱基,C 端 β 发夹延伸至小沟,α5 螺旋与 DNA 骨架相互作用,且二聚体通过极性和疏水作用稳定。此外,PhoP 结合会占据 - 35 元件区域,干扰 σAR4 与 - 35 元件的经典相互作用。功能验证表明,PhoP 中参与 DNA 结合和二聚化的关键残基(如 E161A、S219L 等)突变后,体外转录活性显著降低,证实这些残基对 PhoP 的调控功能至关重要,同时也解释了减毒菌株中 PhoP S219L 突变导致毒力下降的分子机制。
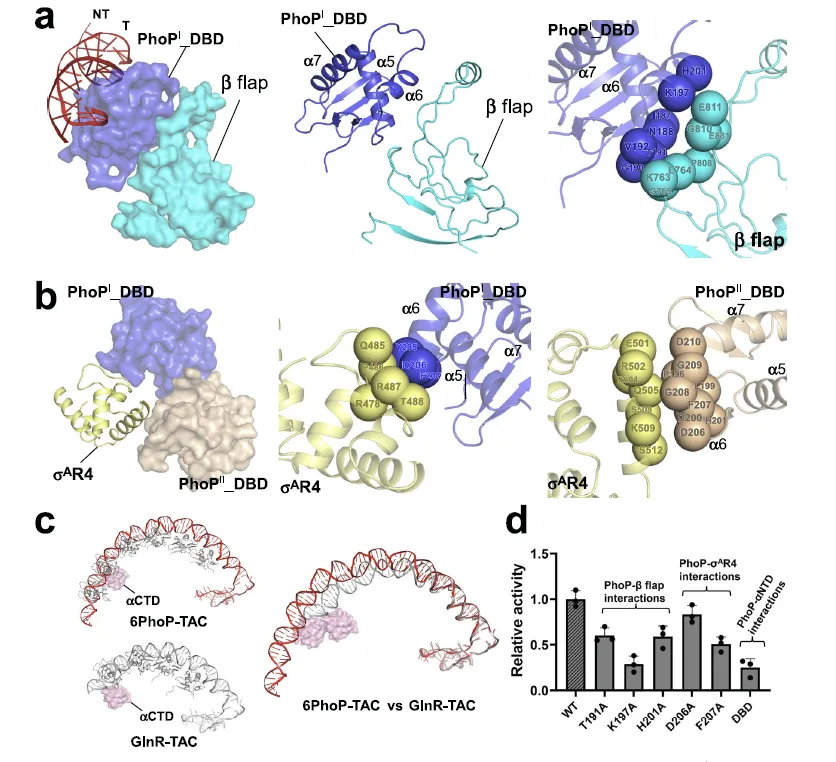
图 3:Mtb PhoP 与 RNAP 保守结构域的蛋白 - 蛋白相互作用及功能验证
该图揭示了 PhoP-TAC 中 PhoP 与 RNAP 的 β flap、σAR4 及 αCTD 结构域之间的关键相互作用,这些作用是维持复合物稳定性和转录激活功能的核心。PhoPI-DBD 的 α6 螺旋通过极性和疏水作用与 RNAP β flap 的环结构结合,PhoPI-DBD 和 PhoPII-DBD 还分别与 σAR4 形成静电作用和螺旋 - 螺旋相互作用。结构对比显示,6PhoP-TAC 中的 αCTD 位置较 GlnR-TAC 上游偏移约 2 nm,且仅在 6PhoP-TAC 中出现,提示其对多 PhoP 组装复合物的稳定作用。功能实验证实,PhoP 中参与上述相互作用的残基(如 T191A、K197A 等)突变或 REC 结构域截短后,转录激活活性显著下降,其中 K197A、F207A 突变和 DBD 截短的影响最为明显,直接证明了这些蛋白 - 蛋白相互作用在 PhoP 介导的转录激活中的必要性。
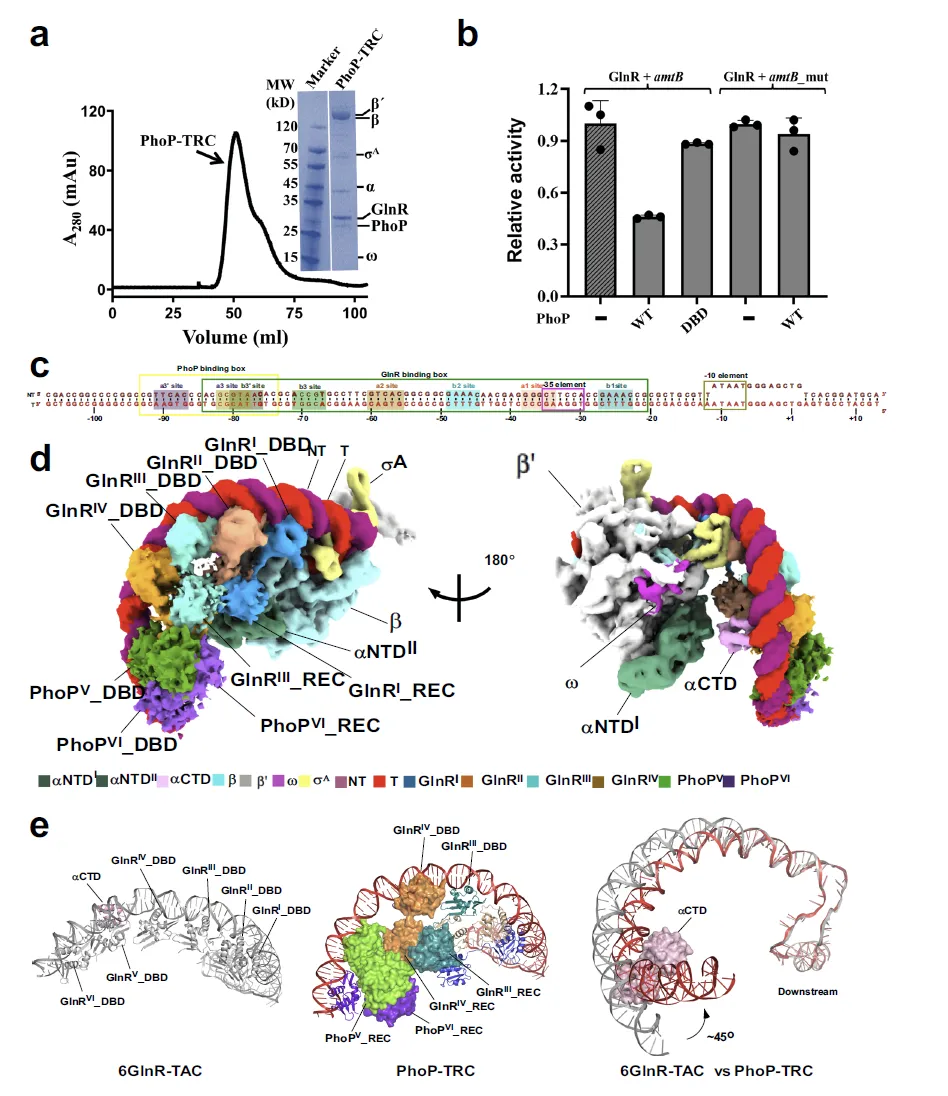
图 4:Mtb PhoP-TRC 的组装、结构特征及转录抑制机制
该图围绕 PhoP-TRC 展开,涵盖复合物组装验证、功能分析、DNA 支架设计、冷冻电镜密度图及结构对比。SDS-PAGE 和凝胶过滤分析证实 PhoP、GlnR、RNAP 与 amtB 启动子成功组装为 PhoP-TRC;体外转录实验显示,PhoP 可显著降低 GlnR 依赖的 amtB 启动子转录活性,而 PhoP REC 结构域截短或 amtB 启动子上 PhoP 结合位点突变后,抑制作用减弱。DNA 支架中包含 PhoP 结合盒(a3’-b3’位点)和四个 GlnR 结合位点,冷冻电镜密度图展示了各组分的结合模式。结构对比表明,PhoP 二聚体结合 amtB 上游 PHO 盒后,导致 DNA 间隔区发生约 45° 扭曲,且 RNAP αCTD 向下游移位并与 DNA、GlnR 相互作用,这种扭曲形成的空间位阻阻碍了第三个 GlnR 二聚体的结合,进而抑制转录,为 “竞争性遮挡模型” 提供了直接结构证据。
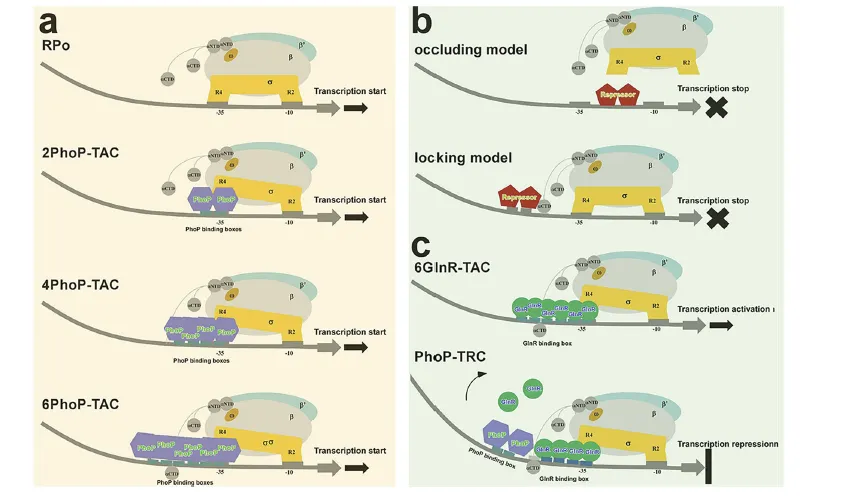
图 5:PhoP 依赖的转录调控工作模型
该图通过示意图整合了 PhoP 作为激活剂和抑制剂的双重调控机制,直观呈现其不同功能模式。左侧展示了经典 RPo 及三种 PhoP-TAC(2PhoP-TAC、4PhoP-TAC、6PhoP-TAC)的转录激活模式,PhoP 分别以二聚体、四聚体、六聚体形式结合不同数量的 PHO 盒,通过干扰 σAR4 与 - 35 元件的相互作用及与 RNAP 的多重蛋白互作,启动目标基因转录。中间对比了经典转录抑制模型(遮挡 RNAP 结合位点或锁定 RNAP)与 PhoP 的独特模式。右侧详细阐释了 “竞争性遮挡模型”:无 PhoP 时,六个 GlnR 分子协同结合 amtB 启动子激活转录;有 PhoP 时,其串联二聚体竞争性结合上游 a3’-b3’位点,与 GlnR、RNAP αCTD 相互作用并扭曲 DNA,阻碍第三个 GlnR 二聚体结合,抑制 6GlnR-TAC 形成,最终实现转录抑制,该模型整合了结构和功能数据,清晰揭示了 PhoP 双重调控的分子逻辑。
4.研究总结
本研究通过冷冻电镜结构解析与功能验证,阐明了结核分枝杆菌 PhoP 蛋白的双重转录调控分子机制:转录激活时,PhoP 以串联二聚体 / 四聚体 / 六聚体形式结合多 PHO 盒启动子,通过取代 σAR4 与 - 35 元件的相互作用及与 RNAP 的多重蛋白互作,启动目标基因转录,属于独特的 IV 型 σ70 家族转录激活因子;转录抑制时,PhoP 竞争性结合交叉调控启动子的上游 PHO 盒,扭曲 DNA 结构并阻碍 GlnR 结合,通过 “竞争性遮挡模型” 抑制氮代谢基因表达。PhoP 关键残基的功能验证为理解其调控特异性及减毒菌株机制提供了结构依据,其高度保守性及关键作用使其成为抗结核药物研发的潜在靶点,同时为 OmpR/PhoB 家族调控因子的双重功能研究提供了范式。
局限性:PhoP-TRC 结构为初步模型,PhoP_REC 与 GlnR_REC 区域的电子密度不完整;未探究体内环境中 PhoP 调控的动态变化及其他调控因子的协同作用。
展望:后续可优化样品条件解析更高分辨率的 PhoP-TRC 结构,结合体内实验验证调控机制;探究 PhoP 与其他信号通路的交叉对话,开发靶向 PhoP-DNA 或 PhoP-RNAP 相互作用的小分子抑制剂,为结核病治疗提供新策略。
文献来源:Shi J, Feng Z, Song Q, et al. Structural insights into transcription regulation of the global OmpR/PhoB family regulator PhoP from Mycobacterium tuberculosis. Nat Commun. 2025;16(1):1573. Published 2025 Feb 13. doi:10.1038/s41467-025-56697-x
#结核分枝杆菌#PhoP蛋白#转录调控#冷冻电镜#OmpR#PhoB家族#双重机制#抗结核靶点#GlnR交叉调控

国家杰青一对一答疑视频
医学省自然申请答疑,立项的关键条件是哪一些?从哪些方向可以杀出重围
临床型博士如何准备国青标书?没有预实验怎么办?专家一对一解答规划
中医药科研研究