大环化反应是将线性前体转化为环状产物的过程,是天然产物生物合成中普遍存在的策略,可增强分子的结构多样性和刚性,最终影响这些化合物的生物活性。
虽然常见的五元或六元环的形成相对简单,但大环(>12元环)的构建因无环前体的构象灵活性而面临独特挑战。为克服这些挑战,自然界进化出了多种生物合成策略(补充图1)。
其中一种主要方法是硫酯酶介导的大环化,常见于大环内酯和大环内酰胺的生物合成中。细胞色素P450、 Rieske氧化酶和自由基S-腺苷-L-甲硫氨酸酶等酶类,分别在万古霉素、间环丙菌素和链肽等化合物的大环化过程中发挥重要作用。
在羊毛硫肽的生物合成中,LanC及其同源物通过半胱氨酸残基与脱氢氨基酸之间的迈克尔型加成反应形成硫醚交联。在硫肽和吡咯并吲哚霉素类天然产物中,还观察到过环化酶介导的大环化反应。
近年来的研究发现了多种新型大环化策略:例如,新发现的大环化酶AvmM在阿尔奇霉素A的生物合成中,通过串联的β-消除反应和迈克尔加成反应催化16元大环的形成;此外,单胺氧化酶家族蛋白LkcE通过异常的酰胺氧化反应,随后发生分子内曼尼希反应,在抗生素兰卡杀菌素的生物合成中促进聚酮大环的形成。这些发现凸显了大环化相关酶促机制的复杂性和多样性。
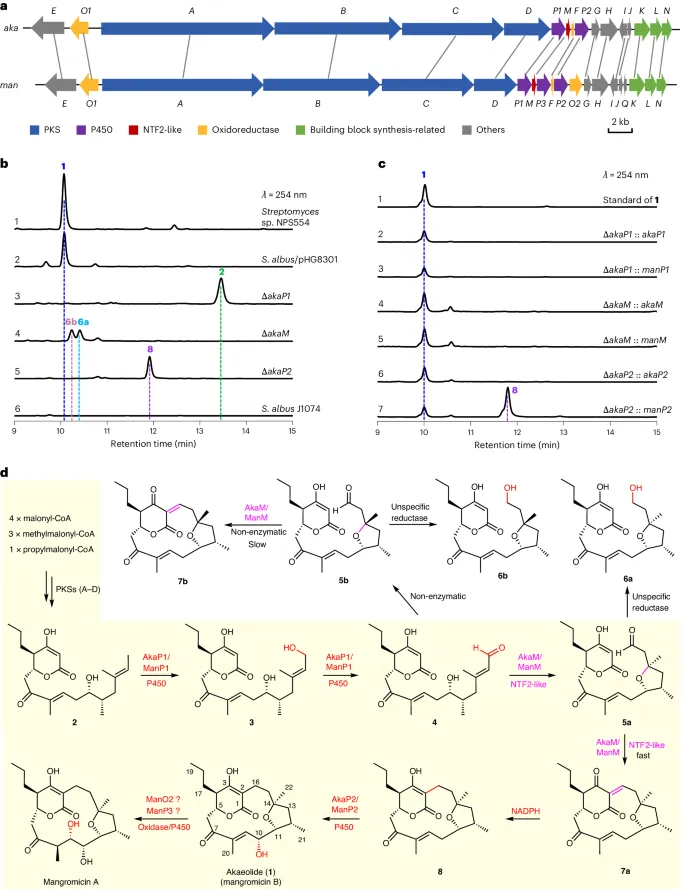
赤霉内酯(AKA,1)和曼格霉素(MAN)是含β-酮-δ-内酯单元的15元大环聚酮化合物(图1d),分别从链霉菌NPS554和空气殖民勒氏菌NBRC 13195中分离得到。与细菌I型聚酮合酶(PKSs)产生的典型大环内酯不同,AKA和MAN是完全碳环聚酮化合物,代表了一类独特的聚酮大环,暗示其存在不同的环化机制。
AKA和MAN的生物合成基因簇(BGCs)高度保守,均编码四种具有相同模块和结构域的巨型I型聚酮合酶(图1a及补充表3和表4)。此外,两个基因簇均编码一组同源修饰酶,包括两种P450酶(P1和P2)、一种核转运因子2(NTF2)样酶(M)、一种氧化还原酶(O1),以及负责合成稀有丙二酰辅酶A构建单元的酶(K、L、N)——该构建单元也参与FK506的生物合成。
生物信息学分析表明,四种模块化I型聚酮合酶最初合成线性聚酮化合物,这些线性产物作为新生产物含有特征性的β-酮-δ-内酯单元(补充表3和表4及补充图2和图3)。然而,末端甲基与远端β-酮-δ-内酯单元偶联形成完全碳环结构的精确机制仍不明确。基于揭示天然产物生物合成中独特酶促大环化机制的潜力,我们着手研究AKA的生物合成途径。
南京大学戈惠明/张博通过基因组挖掘,研究人员发现了一类具有这种串联环化能力的NTF2样蛋白家族。与底物模拟物结合的X射线晶体结构分析及基于结构的定点突变实验表明,赖氨酸残基可与末端醛基形成亚胺离子中间体以启动环化反应,而天冬氨酸残基则作为通用碱介导质子转移。捕获从线性前体到环化前状态等不同反应阶段的晶体结构,为关环过程提供了直接见解。
本研究阐明了一种亚胺离子催化的串联环化机制,拓展了NTF2样酶已知的催化范围,并凸显了亚胺离子介导的生物催化在天然产物生物合成中的潜力。
戈惠明 教授
国家杰青,南京大学生命科学学院副院长
2002及2007年在南京大学生命科学学院分别获得学士和博士学位,而后留校工作,并分别在2010-2012以及2012-2015年间在南京大学化学院和美国Scripps研究所化学系进行博士后研究工作。在2010、2015年和2019年分别获得教育部新世纪优秀人才、基金委优青的资助和国家杰青。2015年至今是南京大学生命科学学院教授。
张博是南京大学生命科学学院副教授,主要从事天然产物生物合成与酶工程研究。
https://www.nature.com/articles/s44160-025-00989-z