南京邮电大学 | 突破心梗治疗瓶颈!无线可编程 ePOWER 贴片原位产生活性囊泡,修复心脏功能新方案
- 2026-02-02 20:46:14

导读
针对心梗治疗中外源性药物药代动力学不佳、细胞疗法存在肿瘤风险及 EV 疗法产量低、靶向性差等问题,研究团队设计了无线可编程 ePOWER 贴片,通过柔性导电层与生物黏附水凝胶封装 M2 型电敏感巨噬细胞,经无线电刺激激活细胞内钙信号通路,原位高效产生治疗性 EV;该设计无需外源性 EV 扩增与递送,在大鼠心梗模型中证实可诱导巨噬细胞 M1→M2 表型转换,促进心肌细胞增殖与血管新生,显著缩小梗死面积、改善心功能,为心梗及多种疾病提供了安全高效的一体化治疗平台。
研究亮点
创新性开发无线可编程 ePOWER 生物电子贴片,通过电刺激嵌入的 M2 型巨噬细胞,实现原位高效产生活性 EV,单细 EV 产量提升约 24 倍;贴片采用 DA/PEI/PAA 自凝胶黏附层,适配心脏动态运动,兼具生物相容性与电流屏蔽功能;EV 可直接作用于梗死部位,规避全身递送的清除问题,同时通过调控巨噬细胞极化、促进心肌增殖与血管新生发挥多效治疗作用,构建了 “刺激 - 产泡 - 治疗” 一体化平台,兼具高可编程性与临床转化潜力。
全文归纳总结


研究方法
制备 ePOWER 贴片:以 PEDOT:PSS 为导电层,修饰 L - 精氨酸提升生物相容性,优化 DA/PEI/PAA 黏附水凝胶配方(质量比 1:5:5),确保湿组织黏附强度与 EV 渗透能力;
体外实验:以 M2 型 BV2 巨噬细胞为模型,通过不同电压(0-9V)和刺激时长(0-30min)优化电刺激参数,采用 TEM、Western Blot、NTA 鉴定 EV 形态、标志物与产量,通过钙荧光探针验证钙信号通路机制,借助 Transwell、划痕实验、管形成实验评估 EV 对内皮细胞迁移、血管新生及心肌细胞增殖的影响;
体内实验:建立 SD 大鼠心梗模型,将 ePOWER 贴片植入梗死区域,设对照组、ePOWER 组、阿司匹林组及联合治疗组,通过超声心动图检测心功能,Masson 染色评估纤维化程度,CD31 免疫染色检测血管新生,同时进行器官组织学与血液学毒性评估。
研究结果
贴片性能:优化后的黏附层黏附应力达 58KPa,导电层电压分布均匀,EV 可顺利穿透水凝胶孔隙;
体外 EV 产量与功能:5V、20min 电刺激下,EV 产量较对照组提升 24 倍,且保留典型 EV 标志物(CD63、CD9 等),可诱导巨噬细胞 M1→M2 极化,提升 HUVEC 迁移与管形成能力,促进心肌细胞增殖;
体内治疗效果:大鼠心梗模型中,ePOWER 组左心室射血分数显著提升,梗死面积缩小,血管新生增加,联合阿司匹林治疗效果更优;
安全性:贴片未引起主要器官组织损伤,血液学指标均在正常范围,无明显系统毒性。
研究结论
ePOWER 生物电子贴片通过无线电刺激原位激活巨噬细胞产生治疗性 EV,有效解决了传统 EV 疗法产量低、靶向性差的核心问题。该系统在体外实现 EV 高效生产与功能保留,在体内显著改善心梗大鼠的心脏功能、缩小梗死面积、促进血管新生,且生物相容性良好。其 “原位产泡 - 精准治疗” 的设计理念,规避了外源性 EV 制备与递送的弊端,同时具备电压、时长等参数的可编程性,为心梗治疗提供了全新的一体化方案,也为其他疾病的 EV 疗法开发提供了可借鉴的技术框架。
局限性:体外实验采用脑来源 BV2 巨噬细胞,与临床可用的心肌巨噬细胞存在差异;未深入解析 EV 中关键治疗性 cargo 及其作用机制。展望:后续将替换为临床相关细胞(如心肌巨噬细胞、间充质干细胞),优化电刺激参数适配不同细胞类型;挖掘 EV 中核心功能分子,结合基因工程增强细胞电敏感性;探索微创手术植入方式,拓展至糖尿病、脊髓损伤等其他疾病的治疗。
结果图解


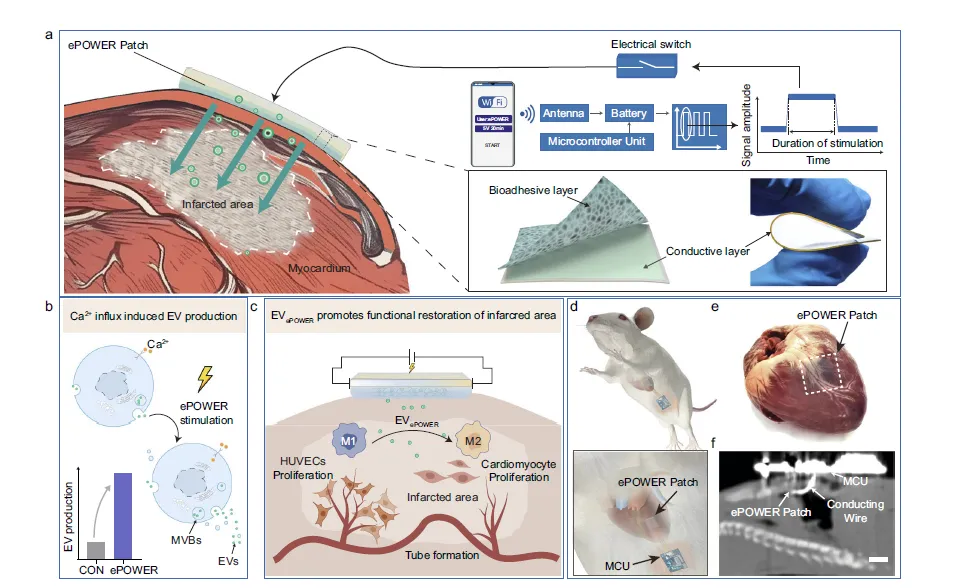
Figure 1:ePOWER 系统的设计原理与体内植入效果
该图系统展示了 ePOWER 贴片用于心梗治疗的核心设计逻辑与实际应用场景。a 图清晰呈现了系统的整体架构,包括含导电层与黏附层的贴片、微控制单元(MCU)和 WiFi 天线模块,通过无线操控实现心梗区域原位产生活性 EV,省去外源性 EV 的扩增与递送步骤,简化治疗流程;b 图揭示了其作用机制,即通过电刺激诱导 M2 型 BV2 巨噬细胞内钙内流,进而激活 EV 生物合成;c 图阐明了生成的 EVePOWER 的治疗路径,可将心梗部位促炎的 M1 型巨噬细胞重编程为抗炎的 M2 型,同时促进心肌细胞增殖、内皮细胞迁移和血管新生,最终修复心肌功能;d、e 图展示了 ePOWER 贴片在大鼠体内的植入状态,能够紧密贴合心脏组织;f 图通过 CT 成像验证了植入系统在大鼠体内的位置,证明该装置可在活体中稳定存在并实现无线调控。
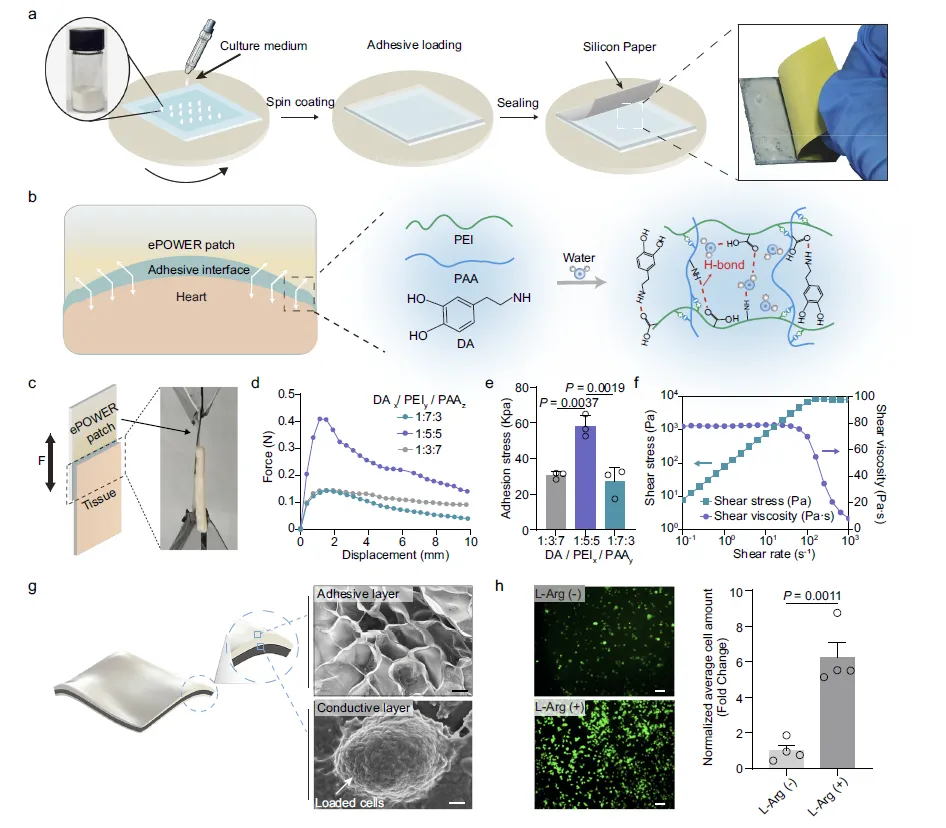
Figure 2:ePOWER 贴片的黏附层性能与生物相容性优化
此图聚焦于 ePOWER 贴片关键组成部分 —— 黏附层的制备、力学性能及生物相容性。a 图描述了黏附层的制备流程,通过冻干法制备 DA/PEI/PAA 粉末,经旋涂均匀分布于贴片表面,并用硅油纸保护以防止水分蒸发;b 图解释了黏附层的黏附机制,由 PEI 与 PAA 形成物理交联框架,多巴胺通过分子间作用力进一步强化黏附网络;c 图展示了搭接剪切试验的示意图与实物图,用于评估黏附强度;d、e 图通过实验数据确定了 DA/PEI/PAA 的最优质量比为 1:5:5,此时黏附应力可达 58KPa,且 zeta 电位和 pH 值利于维持交联密度与低细胞毒性;f 图表明该黏附剂在动态剪切条件下仍保持高黏度(约 78 Pa・s)和低流动性,适配心脏跳动的动态环境;g、h 图显示,导电层经 L - 精氨酸修饰后,能有效支持细胞生长且无明显细胞毒性,同时黏附层的微米级孔隙结构便于 EV 释放,为贴片的体内应用提供了生物相容性保障。
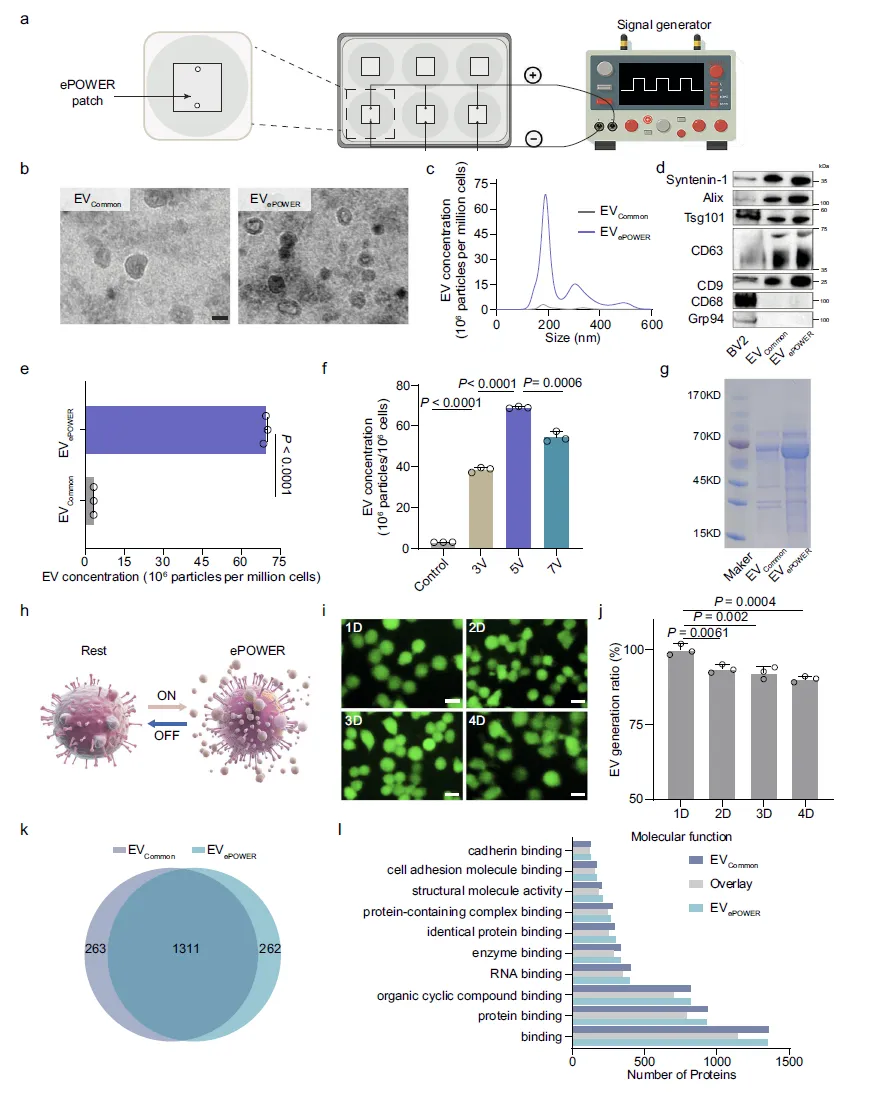
Figure 3:ePOWER 系统促进 EV 高效且稳定产生
该图通过一系列实验验证了 ePOWER 系统在 EV 生产中的优势。a 图展示了 EV 生产的实验装置,BV2 巨噬细胞接种于 ePOWER 贴片后接受电刺激;b 图通过 TEM 观察到,EVePOWER 与常规培养产生的 EVCommon 均呈典型杯状结构,尺寸约 200 nm,形态完整;c 图通过 NTA 定量分析证实 ePOWER 刺激显著提升 EV 浓度;d 图 Western Blot 结果显示,两种 EV 均表达 CD63、Alix、CD9 等典型 EV 标志物,表明 ePOWER 刺激未改变 EV 的核心特征;e 图数据显示,经电刺激后单个细胞的 EV 产量较对照组提升约 24 倍;f 图确定了最优电刺激参数为 5 V、20 分钟,此条件下细胞无明显损伤且 EV 产量最高;g 图 SDS-PAGE 分析表明 EVePOWER 的蛋白信号更强,提示其浓度更高;h-j 图证实 ePOWER 系统可重复稳定产生 EV,连续 4 天刺激后 EV 产量仍保持在 80% 以上;k、l 图通过蛋白质组学分析发现,EVePOWER 与 EVCommon 共享 1311 种相同蛋白,分子功能相近,进一步证明 ePOWER 产生的 EV 具备与天然 EV 一致的生物特性。
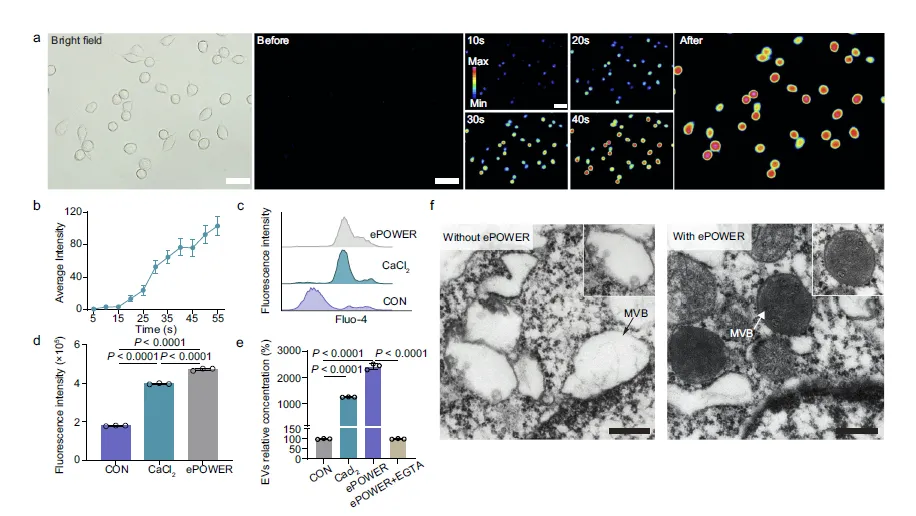
Figure 4:胞内钙内流介导 ePOWER 调控 EV 生物合成的机制
此图深入探究了 ePOWER 系统促进 EV 产生的内在分子机制。a、b 图通过钙荧光探针 Fluo-4 的检测结果显示,随着电刺激时间延长,M2 型 BV2 巨噬细胞内钙荧光强度逐渐升高,表明电刺激可诱导胞内钙内流;c、d 图通过流式细胞术验证,ePOWER 刺激引发的胞内钙水平升高与 CaCl₂处理效果相近,进一步证实钙内流的发生;e 图实验表明,单独使用 CaCl₂可显著提升 EV 产量,而加入钙螯合剂 EGTA 后,ePOWER 诱导的 EV 产量大幅下降,直接证明胞内钙活动是 ePOWER 促进 EV 产生的关键因素;f 图 TEM 观察发现,经 ePOWER 刺激的细胞内多泡体(MVB)中含有的腔内囊泡(ILV)数量显著增多,而 MVB 是 EV 产生的重要亚细胞结构,这为 ePOWER 促进 EV 释放提供了直观的形态学证据,揭示了钙信号通过调控 MVB 形成进而促进 EV 生物合成的路径。
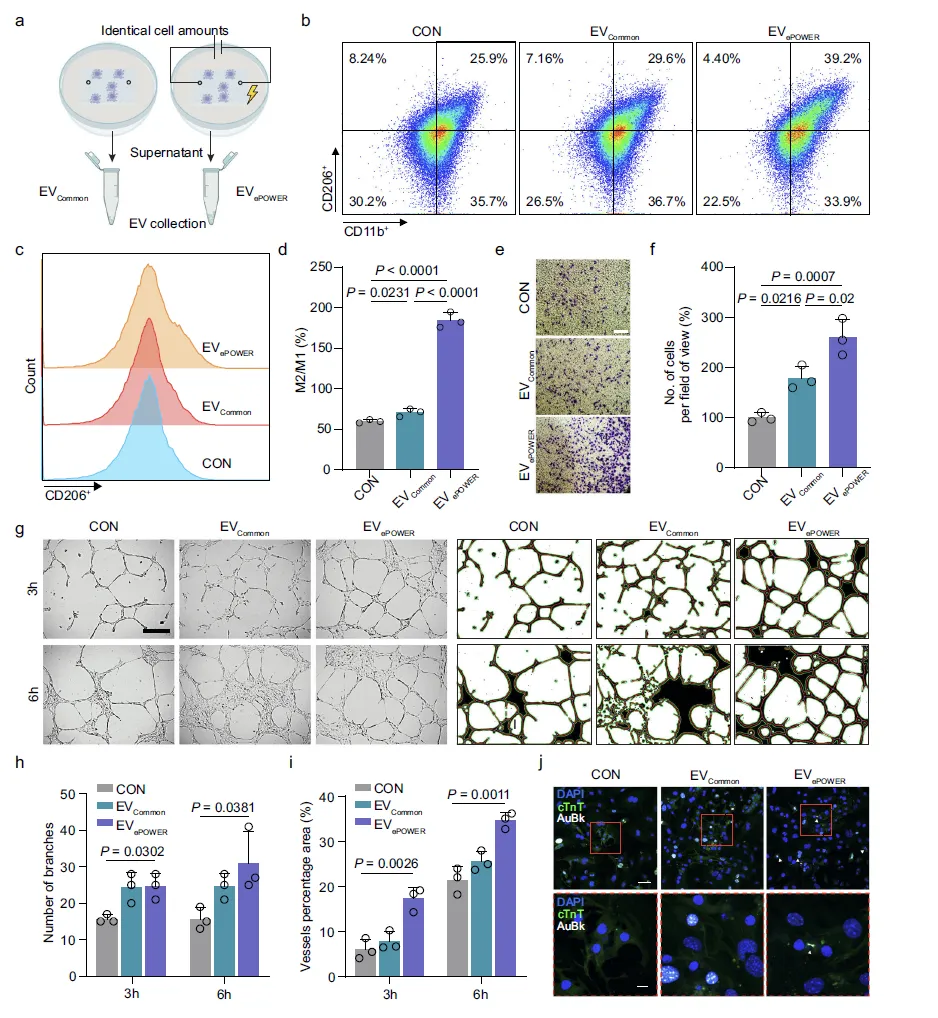
Figure 5:EVePOWER 在体外的生物学功能验证
该图通过体外实验评估了 ePOWER 产生的 EV 在心梗修复相关过程中的功能。a 图示意了 EVCommon 与 EVePOWER 的收集方式,确保两种 EV 来自同等数量的细胞,以保证实验对比的公平性;b-d 图通过流式细胞术检测 M2 型标志物 CD206 的表达,发现 EVePOWER 能更有效地促进心梗部位巨噬细胞从 M1 型向 M2 型极化,且 M2/M1 比值显著高于 EVCommon 组,同时提升抗炎因子 IL-10 的表达,降低促炎因子 TNF-α、IL-1β 等的水平;e、f 图 Transwell 迁移实验表明,EVePOWER 处理组的 HUVEC 迁移能力显著增强;划痕实验进一步证实 EVePOWER 对内皮细胞迁移的促进作用更优;g-i 图管形成实验显示,EVePOWER 能诱导 HUVEC 形成更多、更复杂的毛细血管样结构,且该效应随时间推移(3h 至 6h)更为明显,总血管长度、血管面积占比和连接点数均优于对照组;j、k 图通过免疫荧光染色检测心肌肌钙蛋白 T 和 Aurora B 的表达,证实 EVePOWER 可显著促进心肌细胞增殖,且效果优于 EVCommon,为心梗后的心肌修复提供了功能基础。
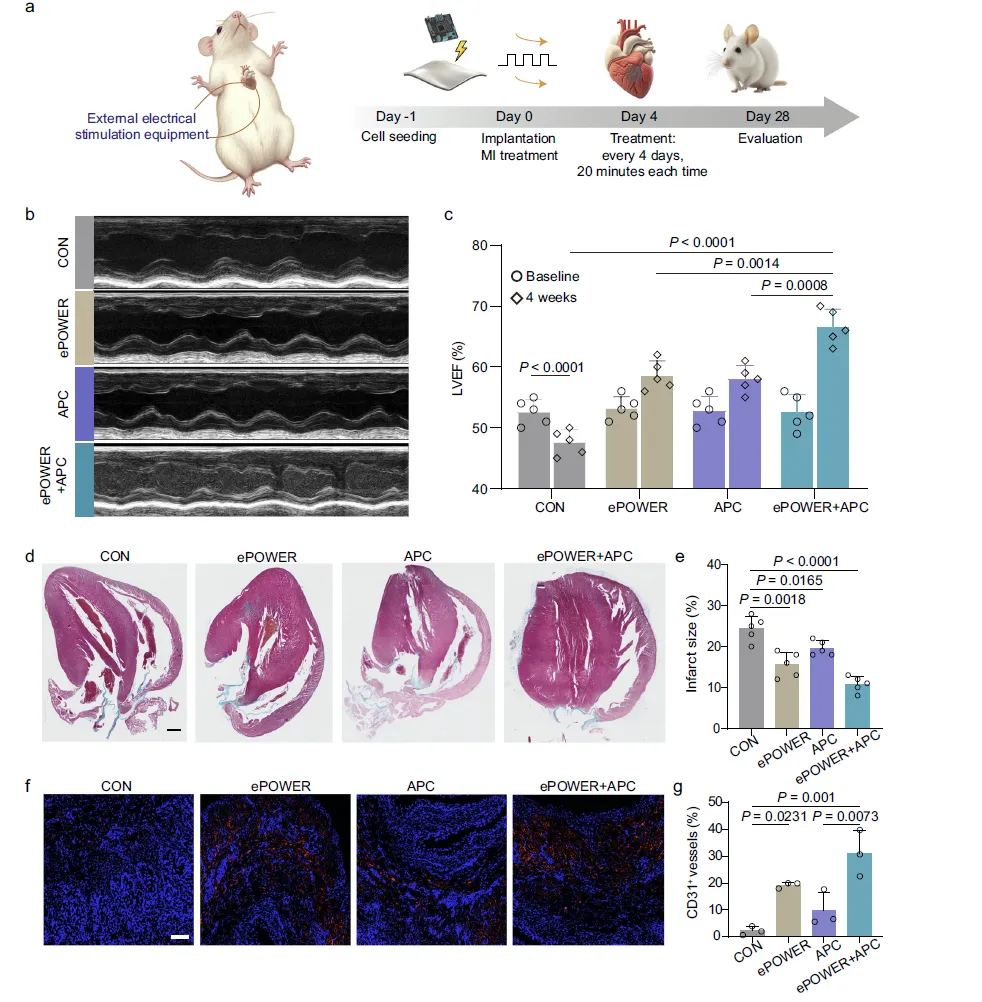
Figure 6:ePOWER 系统在大鼠心梗模型中的治疗效果
此图呈现了 ePOWER 系统体内治疗心梗的关键实验结果。a 图展示了研究设计流程,大鼠心梗模型建立后植入 ePOWER 贴片,设置对照组、ePOWER 组、阿司匹林组及联合治疗组,每 4 天进行一次电刺激,28 天后评估治疗效果;b、c 图超声心动图结果显示,对照组大鼠左心室射血分数(LVEF)显著下降,前壁运动幅度减弱,而 ePOWER 组和阿司匹林组均有改善,联合治疗组的 LVEF 提升最为显著,心脏功能恢复最佳;d、e 图 Masson 三色染色结果表明,对照组梗死区域纤维化严重,而 ePOWER 组和阿司匹林组的梗死面积明显缩小,联合治疗组梗死面积仅约 10%,纤维化程度最低;f、g 图通过 CD31 免疫染色发现,ePOWER 组的血管新生数量显著高于对照组,联合阿司匹林治疗后血管新生进一步增强,为梗死区域的血液供应恢复提供了保障,整体实验证实 ePOWER 系统可有效改善心梗大鼠的心脏功能,缩小梗死面积,且与阿司匹林联合使用效果更佳。
#心肌梗死#细胞外囊泡#生物电子贴片#原位治疗#电刺激#巨噬细胞极化#血管新生#心脏修复

国家杰青一对一答疑视频
医学省自然申请答疑,立项的关键条件是哪一些?从哪些方向可以杀出重围
临床型博士如何准备国青标书?没有预实验怎么办?专家一对一解答规划
