
在细胞层面理解基因功能与调控基因表达,通常离不开两个互相牵连的环节:外源遗传物质进入细胞,以及进入之后细胞生理活动的连续响应。细胞膜作为天然屏障,使得多数药物或基因片段难以直接进入胞质,因而需要借助转染技术完成跨膜递送。传统质粒 DNA 因带负电与细胞膜存在静电排斥,转染耗时且效率偏低,化学载体虽可改善摄取,却依赖内吞过程,容易遭遇内体降解与细胞类型依赖性的效率瓶颈。与之相比,微注射、电穿孔、光穿孔等物理方法能绕开受体识别与内吞限制,但微注射难以规模化,光穿孔对昂贵脉冲激光与显微系统依赖明显,常规电穿孔又往往需要 200 至 1000 V 的高压脉冲,细胞损伤风险随之上升。
递送只是起点,后续如何读出细胞的真实状态同样关键。活细胞存在纳米级机械振动,这类超弱振动与生长、功能与增殖等生物过程相关,因此被视为细胞生理活动的可观测表征之一。然而,在微观尺度进行无创生物力学探测并不容易,原子力显微镜 (AFM)、光学或磁学镊子、流式细胞术与光学追踪等方法各有适用范围与成本门槛;即便微机械悬臂梁可在液体环境中读出振动特征,也多面向黏附细胞群体,单细胞分辨率仍是稀缺能力。更关键的是,能够把基因递送与递送后单细胞生理活动动态监测整合到同一平台上的方案仍然少见。
就在2026年1月28日,来自南京大学医学院与清华大学物理系等团队的李娟与闫汉团队构建了纳米孔阵列介导电穿孔 (NPE) 与纳米孔阵列-石墨烯鼓传感器 (NAGD) 的一体化平台用于实现单细胞层面的基因递送与信号分析,文章发表在 Talanta 上,题为:"A nanosensor platform for cell gene transfection and single-cell nanovibration dynamic monitoring"。
 DOI: 10.1016/j.talanta.2026.129486研究围绕弥漫大 B 细胞淋巴瘤 (DLBCL) 模型细胞 OCI Ly3,构建了纳米孔阵列介导电穿孔 (NPE) 与纳米孔阵列-石墨烯鼓传感器 (NAGD) 的一体化平台,用于实现单细胞层面的基因递送,并以激光干涉方式连续读出递送后细胞纳米振动信号。选择线粒体苹果酸酶 2 (ME2) 作为功能验证靶点,基于其与肿瘤代谢与氧化还原稳态相关的背景,借助 ME2 基因敲低序列 shME2 诱导生理活动变化,从而检验平台对分子扰动的响应能力。核心结论集中体现在纳米振动幅度的可量化变化:单个 OCI Ly3 细胞可产生最高约 20 nm 的随机振荡,而在 shME2 转染后,细胞生理活动受到抑制,随机振荡被明显压低至小于 5 nm,并由此指向面向药筛、肿瘤亚型识别等场景的高通量潜力。
DOI: 10.1016/j.talanta.2026.129486研究围绕弥漫大 B 细胞淋巴瘤 (DLBCL) 模型细胞 OCI Ly3,构建了纳米孔阵列介导电穿孔 (NPE) 与纳米孔阵列-石墨烯鼓传感器 (NAGD) 的一体化平台,用于实现单细胞层面的基因递送,并以激光干涉方式连续读出递送后细胞纳米振动信号。选择线粒体苹果酸酶 2 (ME2) 作为功能验证靶点,基于其与肿瘤代谢与氧化还原稳态相关的背景,借助 ME2 基因敲低序列 shME2 诱导生理活动变化,从而检验平台对分子扰动的响应能力。核心结论集中体现在纳米振动幅度的可量化变化:单个 OCI Ly3 细胞可产生最高约 20 nm 的随机振荡,而在 shME2 转染后,细胞生理活动受到抑制,随机振荡被明显压低至小于 5 nm,并由此指向面向药筛、肿瘤亚型识别等场景的高通量潜力。一、纳米孔阵列电诱导慢病毒递送与孔结构表征
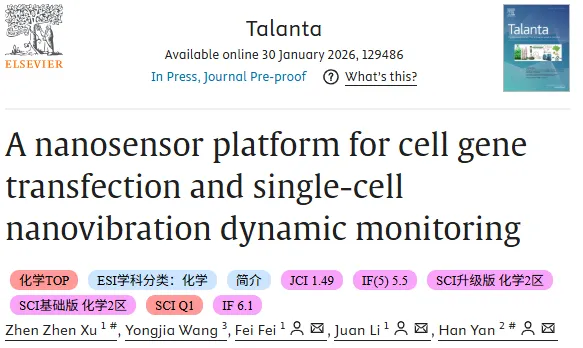
平台的递送链路以固态纳米孔阵列为核心,在外加电压作用下,贴附于阵列表面的细胞膜发生短暂扰动并形成可通行的瞬时通道,使得溶液中带电颗粒能够在电场驱动下由下方流体通道经纳米孔进入上方细胞培养腔,从而提高慢病毒载体进入细胞的概率。阵列化分布带来另一层意义:纳米孔在氮化硅薄膜上均匀排布,使单个细胞受孔覆盖更一致,电穿孔效应趋于均一化,减少由局部电场不均导致的递送差异。
结构表征为递送的可控性提供了直观支撑。透射电子显微镜 (TEM) 图像给出了固态纳米孔阵列的整体形貌,以及单个孔道的局部细节,孔径约 200 nm 的尺度为分子与颗粒跨膜路径提供了几何边界,也为后续与石墨烯鼓膜的耦合奠定了同尺度的结构基础。这一部分的逻辑更像是先把跨膜递送的物理通道建立为可工程化对象,再把可重复的孔阵列几何映射到细胞尺度操作中,确保后续所有功能验证都在一致的硬件前提下展开。
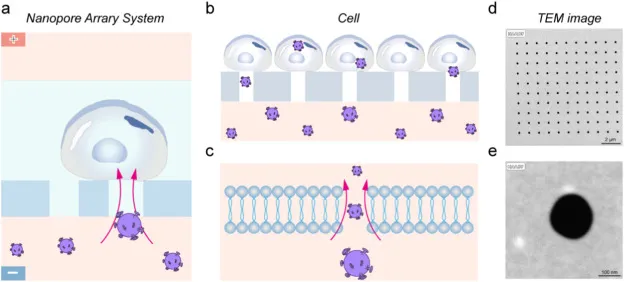 图 1 纳米孔阵列电诱导慢病毒递送与孔结构表征。图 a 至 图 c 为 NPE 系统实现慢病毒载体电诱导进入细胞的示意流程,展示外加电场下跨孔迁移与膜通道形成;图 d 为纳米孔阵列的 TEM 形貌表征;图 e 为单个纳米孔道的 TEM 局部表征,提示孔径约 200 nm。
图 1 纳米孔阵列电诱导慢病毒递送与孔结构表征。图 a 至 图 c 为 NPE 系统实现慢病毒载体电诱导进入细胞的示意流程,展示外加电场下跨孔迁移与膜通道形成;图 d 为纳米孔阵列的 TEM 形貌表征;图 e 为单个纳米孔道的 TEM 局部表征,提示孔径约 200 nm。二、慢病毒转染后的表征
递送效率与细胞状态被同步纳入评价框架。转染效率以免疫荧光方式统计绿色荧光蛋白 (GFP) 阳性细胞比例,并在 0 h、48 h、72 h 等时间点固定染色后计数,至少覆盖 200 个细胞以降低随机视野偏倚。电压参数的比较显示,在 15 V 的短脉冲条件下,细胞活性受影响较弱,而当电压升至 30 V 时细胞活性显著下降;与此同时,15 V 还能获得更高的转染效率,因此被确立为后续实验的优化参数。
在靶点验证层面,shME2 的效应分别从转录、蛋白与功能表型三条线收敛。反转录-定量聚合酶链式反应 (RT qPCR) 的相对表达量结果显示,携带 ME2 敲低序列的慢病毒进入细胞后,ME2 基因表达下降,mRNA 水平随之降低。蛋白层面以蛋白免疫印迹 (Western blot) 得到一致趋势,ME2 蛋白表达被有效压低,从而把敲低效应从核酸层扩展到功能蛋白层。进一步的细胞计数试剂盒 8 (CCK 8) 活力评估提示增殖速率放缓,与生理活动降低相吻合,为后续用纳米振动作为无标记读出提供了生物学方向上的一致性。
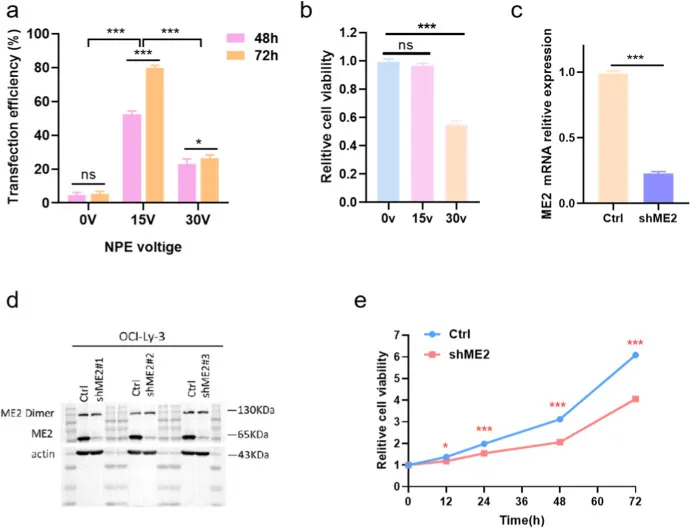 图 2 转染参数优化与 ME2 敲低效应验证。图 a 为不同电压下 NPE 转染效率对比;图 b 为对应电压条件下细胞活性变化;图 c 为 RT qPCR 定量的 ME2 mRNA 相对表达;图 d 为 Western blot 验证的 ME2 蛋白表达;图 e 为 CCK 8 评估的细胞活力随时间变化,数据以均值加减标准差表示。
图 2 转染参数优化与 ME2 敲低效应验证。图 a 为不同电压下 NPE 转染效率对比;图 b 为对应电压条件下细胞活性变化;图 c 为 RT qPCR 定量的 ME2 mRNA 相对表达;图 d 为 Western blot 验证的 ME2 蛋白表达;图 e 为 CCK 8 评估的细胞活力随时间变化,数据以均值加减标准差表示。三、NAGD 传感器的构建
在完成递送链路的可控化之后,传感链路通过在固态纳米孔阵列表面转移石墨烯薄膜实现耦合。图示流程强调的是从金属基底上的石墨烯出发,经湿法转移覆盖到纳米孔阵列表面,使原本用于电穿孔的孔阵列同时成为纳米鼓膜的支撑与腔体结构,从结构上把递送与力学读出对齐在同一器件之上。光学显微镜对比图给出转移前后薄膜覆盖的差异,直观呈现石墨烯在阵列区域的完整性与覆盖均匀度,这类宏观一致性是后续并行化测量与多传感单元统计的前提。
更高分辨率的表征进一步把薄膜从可见的覆盖状态推向可用的材料状态。高分辨 TEM 与聚焦离子束 (FIB) 成像共同确认了石墨烯膜在目标区域的形貌特征,为纳米尺度鼓膜在液体环境下保持悬空、并对细胞诱导的微小位移产生可测响应提供了材料层面的可信度。石墨烯并非被视作单一材料卖点,而是作为原子级薄、光学耦合良好且力学稳健的膜,承担将细胞纳米运动映射为可被光学读出的位移信号这一关键角色。
 图 3 石墨烯膜转移至纳米孔阵列的流程与表征。图 a 为石墨烯膜转移流程示意;图 b 为石墨烯湿法转移到纳米孔阵列表面后的光学显微表征及转移前后对比;图 c 为石墨烯膜的 TEM Talos 表征图像;图 d 为石墨烯膜的 FIB 表征图像。
图 3 石墨烯膜转移至纳米孔阵列的流程与表征。图 a 为石墨烯膜转移流程示意;图 b 为石墨烯湿法转移到纳米孔阵列表面后的光学显微表征及转移前后对比;图 c 为石墨烯膜的 TEM Talos 表征图像;图 d 为石墨烯膜的 FIB 表征图像。四、用于探测单细胞生理活动的 NAGD
传感单元采用单层超薄石墨烯形成的纳米鼓膜,覆盖在直径约 200 nm、深度约 50 nm 的圆形腔体之上,细胞在器件表面的纳米尺度运动会诱导悬空膜发生时间依赖的挠度变化 z(t)。激光干涉测量将这种挠度变化转换为反射光强的调制信号,从而实现对纳米级波动的实时量化;示意图把光路、探测器与样品之间的对应关系讲清楚,使 z(t) 不再是抽象概念,而是可由光信号反演得到的测量量。这种基于鼓膜的结构几何相较传统悬臂梁更有利于降低阻尼与热噪声,为单细胞超弱力学信号提供了更低的噪声底。
为了在不同鼓膜与不同细胞之间进行可比性分析,信号处理引入了平均波动幅度 σ 作为纳米波动强度的度量,基于数分钟 z(t) 轨迹计算得到,并通过中心极限定理方法对提取数据进行处理,以增强统计稳定性。在对照结构中,空白石墨烯、低活性细胞与正常活性细胞对应的光信号强度波动存在层级差异;将这一框架用于 Ctrl 与 shME2 组比较时,shME2 进入细胞后引起的波动幅度显著下降,统计分布也随之整体左移,提示生理活动被抑制。噪声功率谱分析给出了与幅度统计一致的证据链,进一步排除了仅凭时域波形产生的偶然解释,使信号变化更接近细胞状态变化而非测量噪声漂移。
从生物学解释到可验证假设,ME2 被置于代谢与力学响应的连接点。ME2 作为代谢酶,敲低可能影响还原型烟酰胺腺嘌呤二核苷酸与烟酰胺腺嘌呤二核苷酸比值 (NADH/NAD+) 与三磷酸腺苷 (ATP) 产量,ATP 作为细胞骨架动力学与离子泵等过程的能量来源,其下降有可能削弱驱动纳米运动的细胞骨架活动与膜波动,从而在纳米振动层面体现为幅度衰减,并与 CCK 8 所示增殖下降形成互相指向的表型闭环。
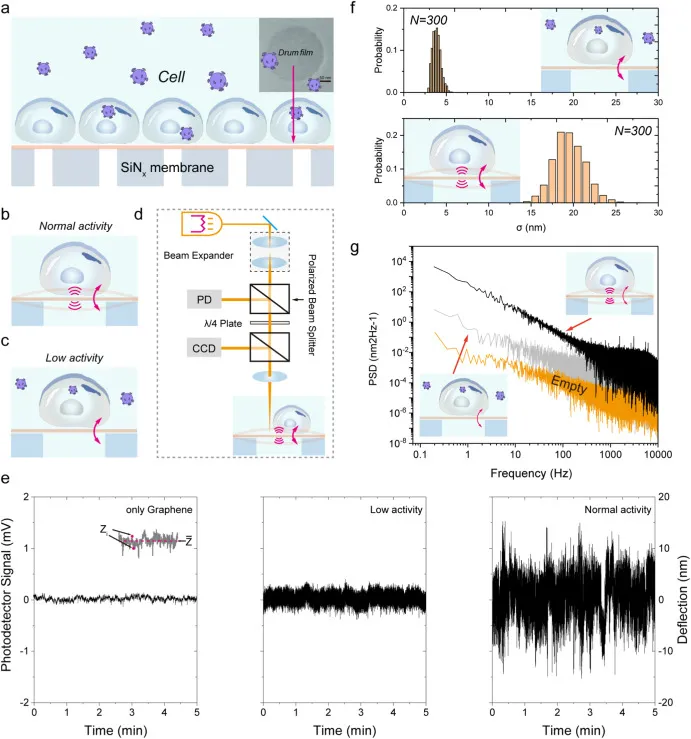 图 4 NAGD 单细胞纳米振动读出原理与 shME2 抑制效应。图 a 至 图 d 为 NAGD 用于实时监测细胞生理活动的示意图与激光干涉读出原理;图 e 为无细胞样品、低活性细胞与正常活性细胞诱导的光信号强度对比;图 f 为 Ctrl 与 shME2 组光信号幅度的统计分析;图 g 为无细胞样品、空白对照与实验组光信号强度的噪声功率谱分析。
图 4 NAGD 单细胞纳米振动读出原理与 shME2 抑制效应。图 a 至 图 d 为 NAGD 用于实时监测细胞生理活动的示意图与激光干涉读出原理;图 e 为无细胞样品、低活性细胞与正常活性细胞诱导的光信号强度对比;图 f 为 Ctrl 与 shME2 组光信号幅度的统计分析;图 g 为无细胞样品、空白对照与实验组光信号强度的噪声功率谱分析。五、细胞生理活动的动态监测
在单次测量能够区分 Ctrl 与 shME2 的基础上,进一步把时间维度引入同一传感器体系,实现 0 至 72 h 的连续动态记录。在长时间培养条件下,超过 90% 的传感器保持功能完整且未见明显破裂或失效,石墨烯的惰性表面使其相对抗生物污染,尽管长时间培养可能出现蛋白与细胞碎片累积,但在实验时间窗内并未显著削弱纳米运动检测这一核心功能。这种稳定性对于单细胞时间序列尤为关键,因为只有当传感器自身漂移与失效概率被压低,时间依赖的幅度衰减才更可能来源于细胞本身的生理变化。
动态数据的读出以波动幅度为主轴展开:在 0 至 72 h 期间,OCI Ly3 细胞的波动幅度呈逐步减弱趋势,幅度分布在中心极限定理处理后表现出随时间推进的系统性迁移,显示 shME2 对生理活动的抑制具有时间依赖特征。统计提取的幅度指标进一步将这一趋势压缩为可比较的时间曲线,结论指向细胞活性随时间下降,并通过补充材料中的多组重复动态实验增强了稳健性。
为了排除非特异性因素,动态监测还引入了更严格的对照:未经慢病毒转染但接受 NPE 处理的 OCI Ly3 细胞,在同样的 NAGD 传感器上监测可达 72 h,纳米振动幅度保持相对稳定;相比之下,shME2 转染组出现显著的时间依赖性下降,从而把振动抑制更明确地归因于 shME2 的特异效应,而非传感环境或自然凋亡等非特异性因素。
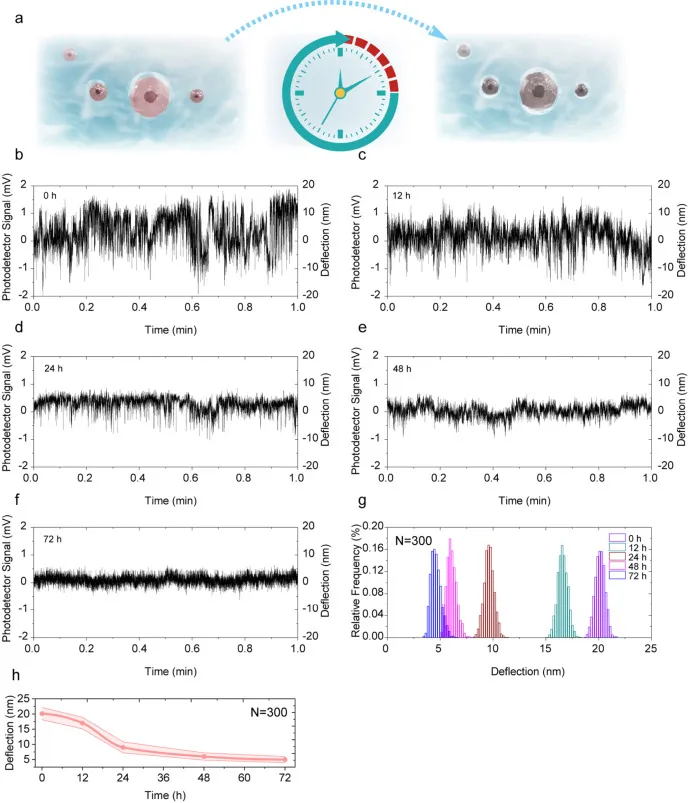 图 5 shME2 转染后单细胞生理活动的 0 至 72 h 动态演化。图 a 为细胞生理活动变化的示意图;图 b 至 图 f 为 shME2 转染后 OCI Ly3 细胞在 0 至 72 h 内不同时间点的生理活动信号变化;图 g 为 0 至 72 h 内波动信号经中心极限定理处理后的幅度分布;图 h 为细胞波动幅度随时间变化的统计结果。
图 5 shME2 转染后单细胞生理活动的 0 至 72 h 动态演化。图 a 为细胞生理活动变化的示意图;图 b 至 图 f 为 shME2 转染后 OCI Ly3 细胞在 0 至 72 h 内不同时间点的生理活动信号变化;图 g 为 0 至 72 h 内波动信号经中心极限定理处理后的幅度分布;图 h 为细胞波动幅度随时间变化的统计结果。总结
综合来看,NPE 与 NAGD 的耦合把基因递送与单细胞纳米振动读出压缩到同一器件平台中,使得分子扰动与力学表型之间可以在连续时间轴上被直接关联。ME2 敲低不仅在 RT qPCR、蛋白表达与增殖活力层面呈现一致抑制效应,也在纳米振动幅度上给出清晰的量化下降,并通过长时程监测与对照实验进一步确认其特异性。
纳米孔阵列作为纳米孔阵列介导电穿孔(NPE)的核心元件,提供了可工程化的跨膜通道。在外加电压作用下,贴附在阵列表面的细胞膜发生瞬时扰动,形成短暂可通行的孔道,使慢病毒载体能够在电场驱动下从下方流体通道经纳米孔进入上方细胞培养腔,并显著提升病毒进入细胞的概率。更具平台意义的一点,纳米孔阵列还是纳米孔阵列-石墨烯鼓传感器(NAGD)的结构基底。研究将石墨烯薄膜转移覆盖到纳米孔阵列表面,使每个纳米孔对应形成一个圆形腔体,石墨烯在孔上方悬空构成纳米鼓膜。细胞在器件表面的纳米尺度运动会诱导鼓膜产生时间依赖的挠度变化,进而通过激光干涉转化为可量化的光信号波动,实现单细胞纳米振动的实时读出。
由于纳米运动检测具备无标记特性,且单个 NAGD 单元可容纳单细胞并通过几何结构降低阻尼与热噪声,石墨烯又兼具稳健、惰性、超薄与良好光学耦合特征,使并行化与临床场景外推具备材料与结构基础,最终指向肿瘤细胞亚型识别与化疗药物敏感性筛查等应用可能。
声明:
本文仅用于介绍与学习分享,如涉及版权问题,请及时与纳米孔测序圈子编辑联系改正或删除。