南京中医药大学陈军教授/东梅副教授&中国药科大学苏志桂教授团队:“一箭双效”自组装纳米酶清除中性粒细胞NETs促进糖尿病创面愈合
- 2026-02-06 08:44:05
点击蓝字
关注我们

Aggregate《聚集体》致力于发表聚集体科学领域的基础和应用研究,涵盖材料化学、物理、生物、应用工程等广泛领域的重要进展和创新性成果。
Aggregate 在科睿唯安发布的期刊引证报告(JCR)中,连续四年位列“化学:综合”,“物质化学”和“材料科学:综合”三个学科Q1区,期刊最新影响因子为13.7;在2025年中国科学院文献情报中心期刊分区表中,位列化学大类一区TOP,并进入三个小类一区!
Aggregate 的收稿范围广泛,单分子或离子层次之上相关研究成果均符合期刊收稿范围,包括但不限于:有机聚集体、无机功能材料、有机 / 无机杂化体系、高分子聚合物、纳米粒子、低维材料、金属有机骨架、超分子组装体、刺激响应体系、清洁能源、光电器件、光伏电池、发光材料、化学传感、生物探针、医学成像、疾病诊疗、药物递送等众多前沿领域。
文章信息

通讯作者:东梅,陈军(南京中医药大学);苏志桂(中国药科大学)
作者:李悦,杨玉叶,张慧颖,辛容双,庞心怡,李天鑫,刘薇,周鑫,张紫诺,王赛龙,苗新未,董洁,郑严,苏志桂*,陈军*,东梅*
Keywords:
diabetic wound
neutrophil extracellular traps
deoxyribonuclease-I
epigallocatechin gallate
nanocomplex
原文链接:
https://doi.org/10.1002/agt2.70235
长按识别二维码进入文章网页
点击文末“阅读原文”浏览全文

文章简介
糖尿病溃疡(DUs)是糖尿病最严重的慢性并发症之一,具有高截肢率和高致死率,给患者及其家庭带来沉重负担。中性粒细胞持续过度释放的胞外诱捕网(NETs)会加剧局部炎症反应,是导致糖尿病溃疡难以愈合的关键因素。因此,清除过度生成的NETs,对于调控创面炎症微环境、促进溃疡愈合至关重要。然而,目前仍缺乏针对清除NETs以促进糖尿病溃疡愈合的有效治疗策略。
本工作基于寡聚表没食子儿茶素没食子酸酯(OEGCG)和脱氧核糖核酸酶-I(DNase-I)之间的结构与功能整合,设计了一种自组装纳米酶(O/DNase-I)。将其应用于糖尿病创面后,该纳米酶可发挥双重协同作用:一方面,DNase-I 通过降解NETs中的细胞外DNA 加速其清除;另一方面,OEGCG 通过抑制中性粒细胞内活性氧(ROS)生成以阻断NETs的释放。该策略可有效下调NETs促炎效应,并上调抑炎巨噬细胞极化,从而实现“一箭双效”,协同促进糖尿病创面愈合(图1)。
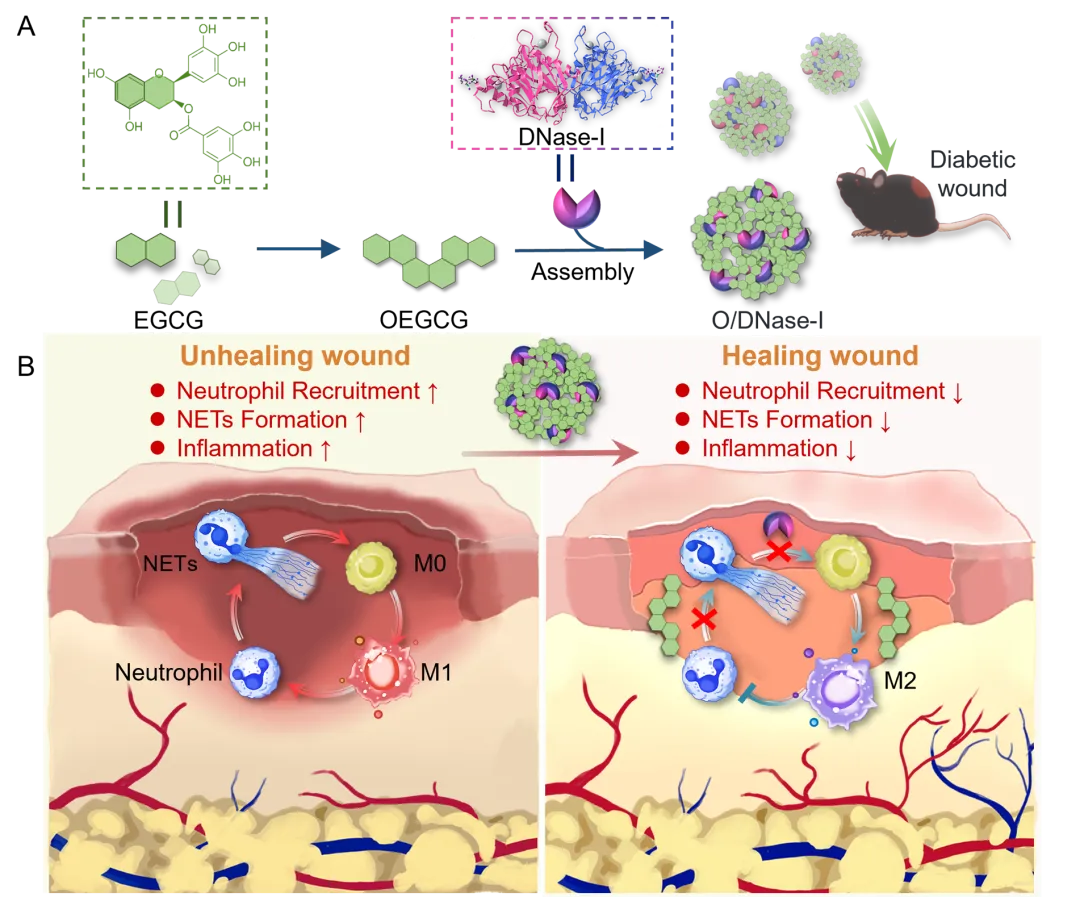
图1. O/DNase-I加速糖尿病创面愈合作用机制示意图
体外实验表明,O/DNase‑I 处理能够有效抑制 PMA 诱导的中性粒细胞过度释放 NETs,并破坏已释放 NETs 的结构完整性,同时显著降低 PMA 刺激下中性粒细胞内的 ROS 水平,从而协同清除 NETs 并抑制中性粒细胞过度活化。此外,过量的 NETs 可通过 TLR‑4/TLR‑9/NF‑κB 轴激活 NLRP3 炎性小体,促使巨噬细胞向促炎 M1 表型极化,导致 IL‑1β、TNF‑α 等促炎因子大量释放,阻碍炎症消退。而经O/DNase-I处理后,该促炎信号通路被抑制,巨噬细胞中 ARG1、IL‑4 等抗炎因子的表达显著上调,进而向抑炎 M2 表型极化,有效抑制了由过量 NETs 引发的炎症反应(图2)。
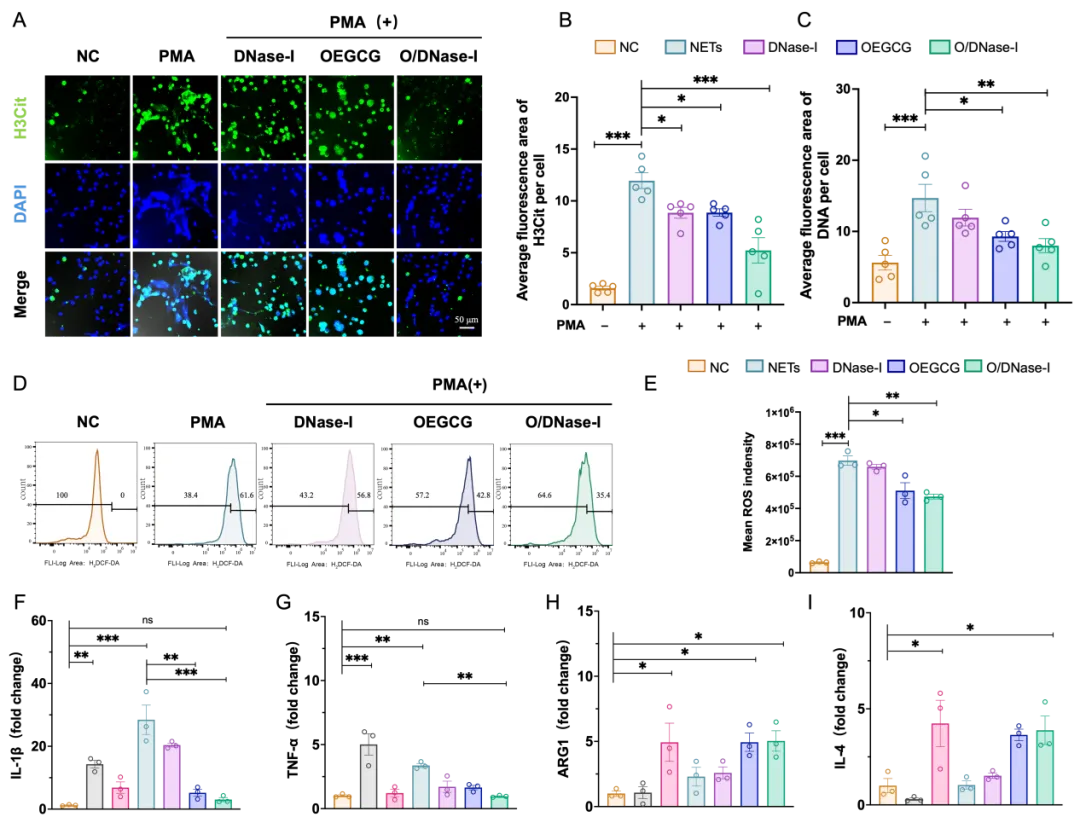
图2. O/DNase-I体外协同清除NETs并促进巨噬细胞M2表型极化
体内实验结果表明,与其他治疗相比,O/DNase‑I 能够显著加速糖尿病小鼠全皮层皮肤缺损模型在炎症期的创面愈合进程(图3)。到第18天的治疗终点,O/DNase‑I 组创面已接近完全再上皮化。机制研究进一步显示,O/DNase‑I 治疗后,在糖尿病创面炎症早期(第4天),皮肤组织中 NETs 标志物瓜氨酸化组蛋白 H3 的表达水平降低,同时中性粒细胞招募也明显减少。这些结果说明,O/DNase‑I 的促愈合作用与其减少创面 NETs 的积累密切相关。
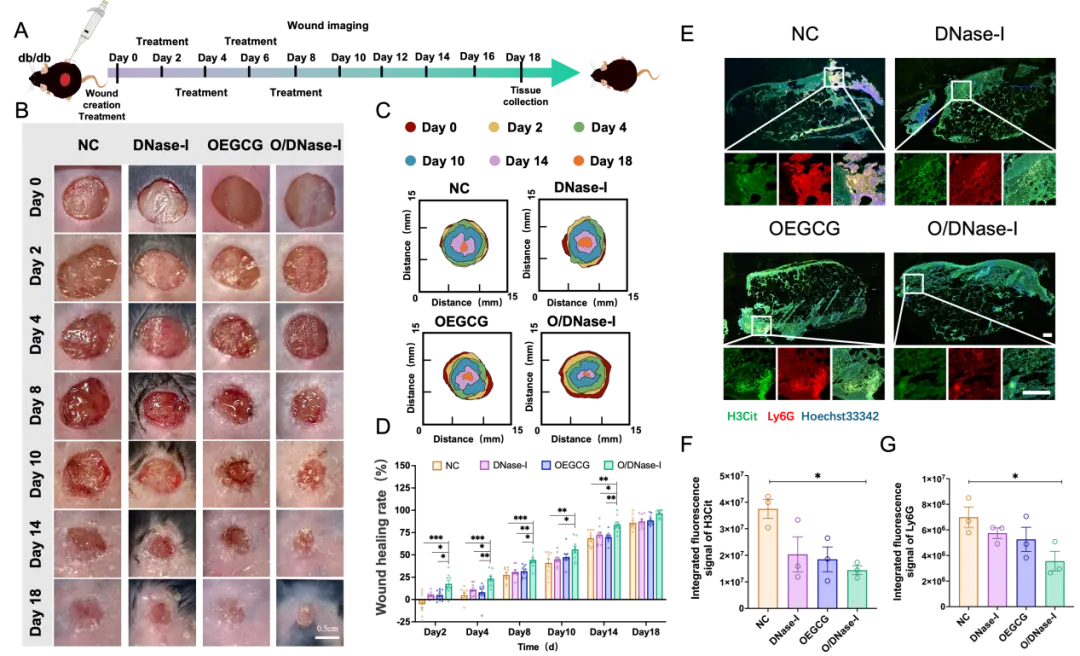
图3. O/DNase-I体内促进糖尿病创面愈合作用
本工作建立了一种针对过度释放NETs而引发炎症失调的新型超分子自组装治疗体系,并验证了该体系可以通过清除糖尿病创面过度释放的NETs实现有效的糖尿病创面管理,为其他过度释放NETs相关疾病治疗提供参考。
以上研究论文以“Self-assembled Nanocomplexes of Oligomerized Catechins and DNase-I for Synergistically enhancing diabetic wound healing”为题发表于Aggregate期刊,论文第一作者为南京中医药大学的硕士研究生李悦,通讯作者为南京中医药大学的东梅副教授、陈军教授和中国药科大学的苏志桂教授。
(Aggregate 2026, 7, e70235.)
通讯作者

东梅,南京中医药大学C类特聘教授,硕士研究生导师。2020年8月加入南京中医药大学药学院药剂系工作。主要从事新型微粒药物递送系统和组织工程先进材料的构建及评价。主持国家级省级项目三项,于国际权威期刊Adv. Funct. Mater.、ACS NANO、J. Controlled Release、Acta Pharm Sin B、Adv. Drug Delivery Rev.、Chem. Eng. J.等刊物发表论文18篇。

陈军,南京中医药大学药学院教授,博士生导师,南京中医药大学学科建设处处长,江苏省中医外用药开发与应用工程研究中心副主任,南京中医药大学中医外用药研究团队带头人,江苏省青蓝工程中青年学术带头人。兼任世界中医药学会联合会经皮给药专业委员会副会长,世界中医药学会联合会中药养颜产业分会副会长。主要从事中医外用药的研究与开发,目前在J. Controlled Release、Acta Pharm Sin B、Adv. Drug Delivery Rev.等期刊发表论文42篇,并获得科研成果获江苏中医药科学技术一等奖(2021,排名第一)。

苏志桂,中国药科大学药学院教授,博士生导师。主要从事改良新药和脂质纳米药物的研发。主持国家自然科学基金、江苏省优秀青年基金项目,在国际权威期刊Adv. Mater.、Angew. Chem. Int. Ed、J. Controlled Release等刊物发表论文20余篇。
往
期
回
顾
2. 中国科学院深圳先进技术研究院张鹏飞副研究员&成都大学梅凌副研究员&韩国高丽大学丁启航博士团队综述:纳米酶治疗非肿瘤疾病
3. 西工大蔺枭副教授/吴淑琪副教授&西安市红会医院李军主任团队:新型MOF封装IrO2纳米酶和反义寡核苷酸组合用于骨关节炎协同治疗
▼

Aggregate 的编辑团队由一批来自世界各地、跨越不同研究领域的杰出专家组成,他们将联手把关期刊的稿件出版,为不同研究领域的作者提供公正的论文评审和快速的出版服务。
Aggregate 鼓励打破学科藩篱,实现研究范式转移,在更高的结构层次上探索更复杂的系统和过程。
Aggregate 是一本开放获取期刊,读者可以自由访问所有已发表的文章。欢迎您向 Aggregate 投稿!
欢迎点击左下方 “阅读原文” ,查看文章!

