IF:16.1《ACS Nano》南京大学贾叙东/张秋红:银-邻苯二酚动态氧化还原化学为水凝胶敷料提供具有持续抗氧化和抗菌活性,用于慢性伤口护理
- 2026-02-06 13:35:11
研究背景:
糖尿病伤口已成为全球健康问题,2035年糖尿病伤口患者预计达9000 万-1.5亿人,糖尿病伤口愈合困难,常伴随活性氧(ROS)过度产生和细菌感染,导致炎症持续、上皮化和血管再生受阻。现有水凝胶敷料虽具备一定抗氧化和抗菌(A&A)功能,但活性多为短效且不可再生,需频繁更换,不仅干扰愈合过程,还会增加治疗成本、并发症风险和医疗废弃物。因此,开发具有长效A&A活性、能实现“无干扰愈合”的水凝胶敷料具有重要意义。

针对上述问题,南京大学贾叙东、张秋红团队与东部战区总医院任建安、吴秀文团队合作,设计了一种纳米氧化还原反应器——银沉积墨鱼汁纳米颗粒(AgCINPs),通过构建银-儿茶酚动态氧化还原化学体系,协同结合Ag诱导的儿茶酚-醌可逆循环(再生儿茶酚基团)与儿茶酚-Ag⁺氧化还原反应(再生Ag/Ag⁺),实现了抗氧化儿茶酚基团的持久再生和抗菌Ag⁺的控释。将该AgCINPs掺入水凝胶后,所得NPs-PSH水凝胶可持续清除ROS并根除细菌超过8天,同时具备优异的生物粘附性(14.21 kPa)、生物相容性、导电性(0.42 S m⁻¹)和韧性(506.15 kJ m⁻³)。在糖尿病大鼠模型中,NPs-PSH通过促进上皮化、减少炎症和增强血管再生,表现出增强的伤口愈合功效,且无需频繁更换敷料(佩戴时间长达7天)。该研究为长效治疗策略和无干扰伤口愈合提供了范式。该文章于2025年6月12日以《Silver–Catechol Dynamic Redox Chemistry Provides Hydrogel Dressings with Sustained Antioxidant and Antibacterial Activity for Chronic Wound Care》为题发表于《ACS Nano》(DOI:10.1021/acsnano.5c04690)。
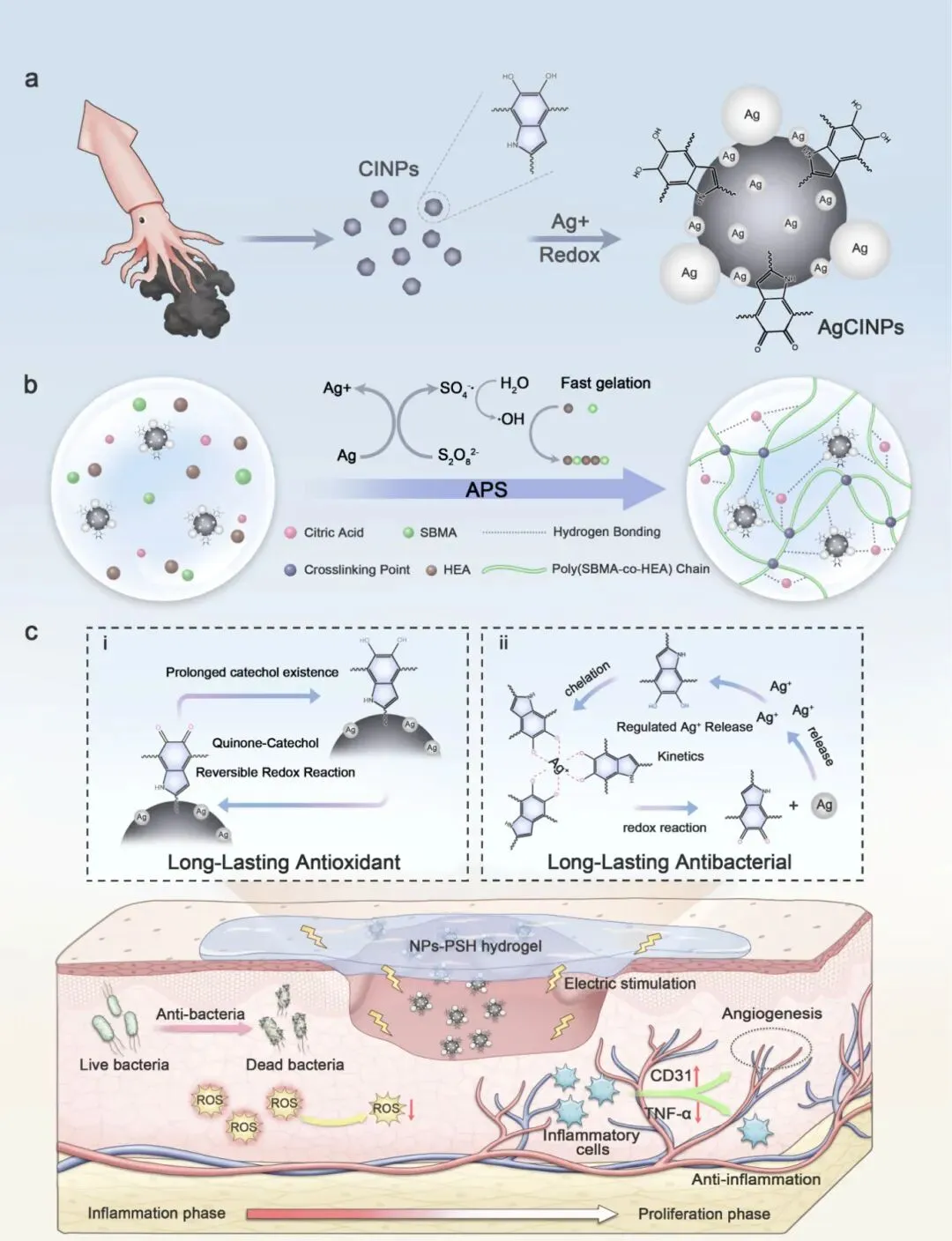
图1. NPs-PSH水凝胶敷料的设计策略。(a)AgCINPs制备示意图。(b)AgCINPs与APS之间的氧化还原反应引发水凝胶前体溶液在环境条件下快速凝胶化制备NPs-PSH水凝胶。(c)NPs-PSH水凝胶敷料的持久抗氧化和抗菌活性及其对糖尿病伤口的治疗机制示意图,包括抗菌、抗氧化、抗炎和电活性功能。
(1)AgCINPs的设计、制备与表征
AgCINPs通过CINPs与银氨络合物的一步氧化还原反应合成,其中AgNPs的表面等离子体共振促进儿茶酚-醌可逆转化,儿茶酚基团还原Ag⁺并调节其释放动力学,二者协同构成Ag-儿茶酚动态氧化还原体系,实现持久的抗氧化与抗菌特性。表征结果显示:CINPs平均直径约177 nm,AgCINPs含20-80 nm及约5 nm两种尺寸AgNPs;HRTEM显示Ag(111)晶面晶格条纹,SAED证实Ag多晶结构;Zeta电位为-26.3 mV;XRD在38.1°、44.4°、64.4°、77.4°、81.5°处显示Ag特征峰;XPS证实零价Ag存在(368.4 eV、374.4 eV);FTIR显示AgCINPs中O-H峰减少、C=O峰出现于1634和1755 cm⁻¹。生物学实验显示AgCINPs对L929细胞毒性低,可有效清除ROS,并对金黄色葡萄球菌具有显著杀菌效果。机制研究表明:UV-vis光谱在418 nm处显示Ag的SPR吸收;瞬态光电流响应证实SPR电子产生;CV显示AgCINPs在0.22和0.26 V处呈准可逆特征,阴极/阳极峰值电流比接近1;XPS显示7天内AgCINPs的C-O含量始终高于C=O,证实其维持儿茶酚基团的能力。
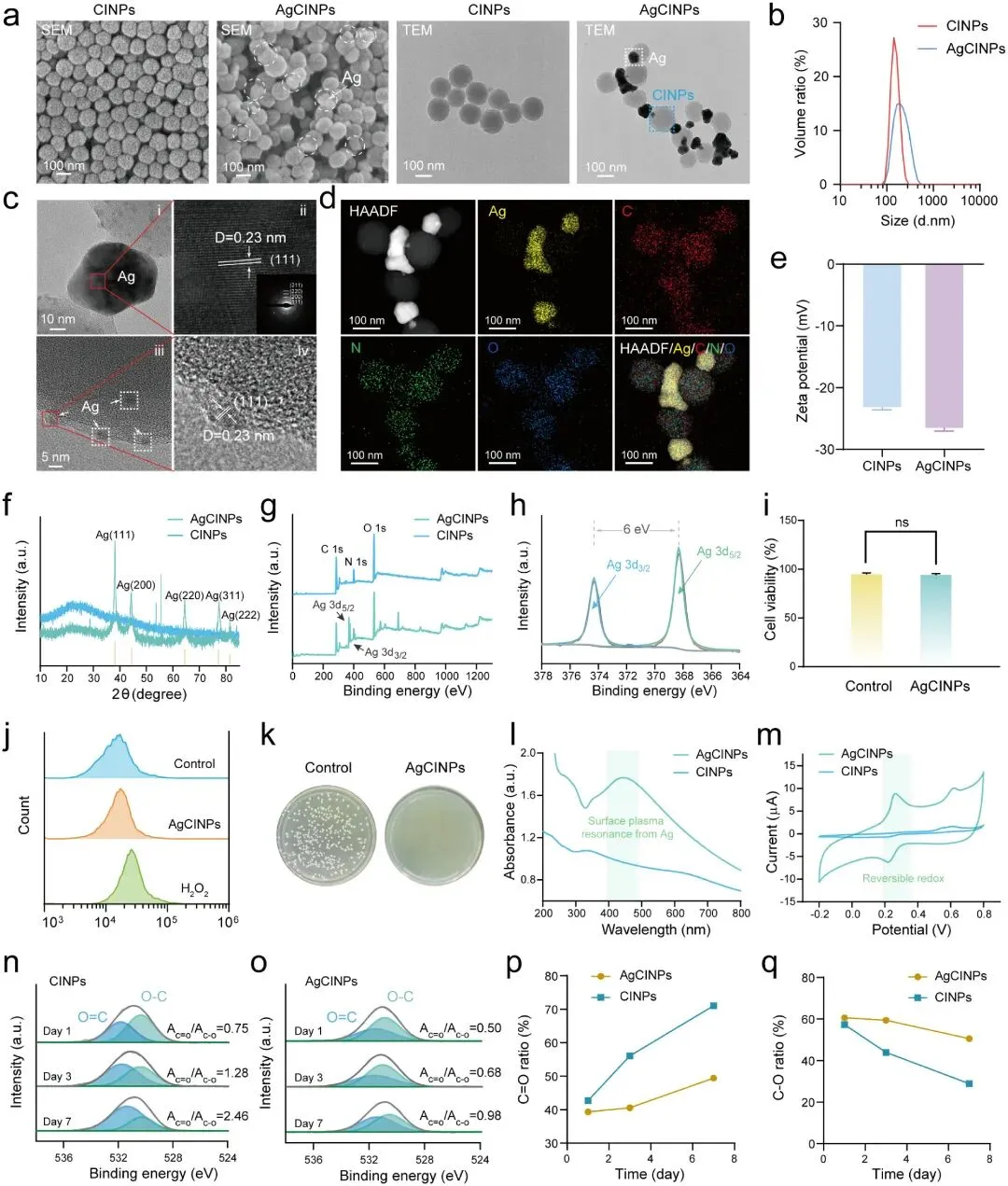
图2.AgCINPs的表征。(a) CINPs和AgCINPs的SEM和TEM图像(b) CINPs和AgCINPs的流体动力学尺寸分布(c) AgCINPs中银的HRTEM图像(插图为SAED衍射花样)(d) AgCINPs的TEM-EDS元素分布图(e) Zeta电位、(f) XRD谱图、(g) XPS谱图(h) AgCINPs的高分辨率Ag 3d谱图(i) AgCINPs的细胞毒性(j) 以DCFH-DA为ROS探针,流式细胞术分析AgCINPs处理的L929细胞(k) AgCINPs对金黄色葡萄球菌(S. aureus)的抗菌能力(l) CINP和AgCINP溶液的紫外-可见光谱(m) CINPs和AgCINPs的循环伏安(CV)实验(n, o) 随时间变化的CINPs和AgCINPs溶液的高分辨率O 1s XPS谱图(p, q) 基于图n, o的C=O与C-O比例定量分析。
(2)AgCINP掺入水凝胶的制备与表征
AgCINPs掺入水凝胶通过将AgCINP悬浮液与SBMA、HEA和柠檬酸混合后加入APS实现自发凝胶化,无需外部能量输入,所得水凝胶命名为xNPs-PSH。流变学显示储能模量约7分钟后超过损耗模量,凝胶时间随AgCINPs质量从0.05 g增至0.20 g而从12.6分钟降至7.0分钟,且存在自加热现象。FTIR显示1636 cm⁻¹处C=C伸缩振动峰和780-830 cm⁻¹扭转振动峰几乎消失;0.20NPs-PSH呈多孔三维结构,AgCINPs分布于基质中。EPR表征显示:CINPs、APS、CINPs+APS和AgCINPs均不能诱导凝胶化,而APS与AgCINPs组合可在25°C下快速诱导凝胶化;AgCINP和CINP溶液均显示g值2.004的醌/半醌自由基信号,但单独存在时不能引发凝胶化;DMPO捕获实验显示APS溶液室温下无显著自由基信号,而AgCINPs+APS溶液显示SO₄⁻•和•OH的显著信号,表明AgCINPs通过催化APS产生自由基引发聚合。
0.05NPs-PSH至0.20NPs-PSH水凝胶的最大拉伸应变从578%增至1124%,高于PSH水凝胶的367%,拉伸和压缩强度均高于PSH水凝胶,0.20NPs-PSH压缩断裂伸长率为85%(PSH为80%),最大韧性为506.15 kJ m⁻³;500%应变下十次拉伸循环后恢复效率达90%;AFM显示杨氏模量从PSH的0.87增至0.20NPs-PSH的4.36 MPa。导电性测试显示0.20NPs-PSH导电性为0.42 S m⁻¹(PSH为0.06 S m⁻¹),NPs-PSH系列导电性(0.26-0.42 S m⁻¹)与人体组织相当,0.20NPs-PSH在10²-10⁵ Hz频率下阻抗<40 Ω。粘附性测试显示NPs-PSH可粘附于PE、陶瓷、玻璃、橡胶、PTFE、坚果壳、钢材和生物组织,0.20NPs-PSH(15×15×1 mm)可承受200 g重量,对猪皮肤粘附强度随AgCINP含量增加而增加,0.20NPs-PSH达14.2 kPa,20次剥离-粘附循环后仍为11.5 kPa,对玻璃、钢材和木材分别为25.1、17.7和42.1 kPa。
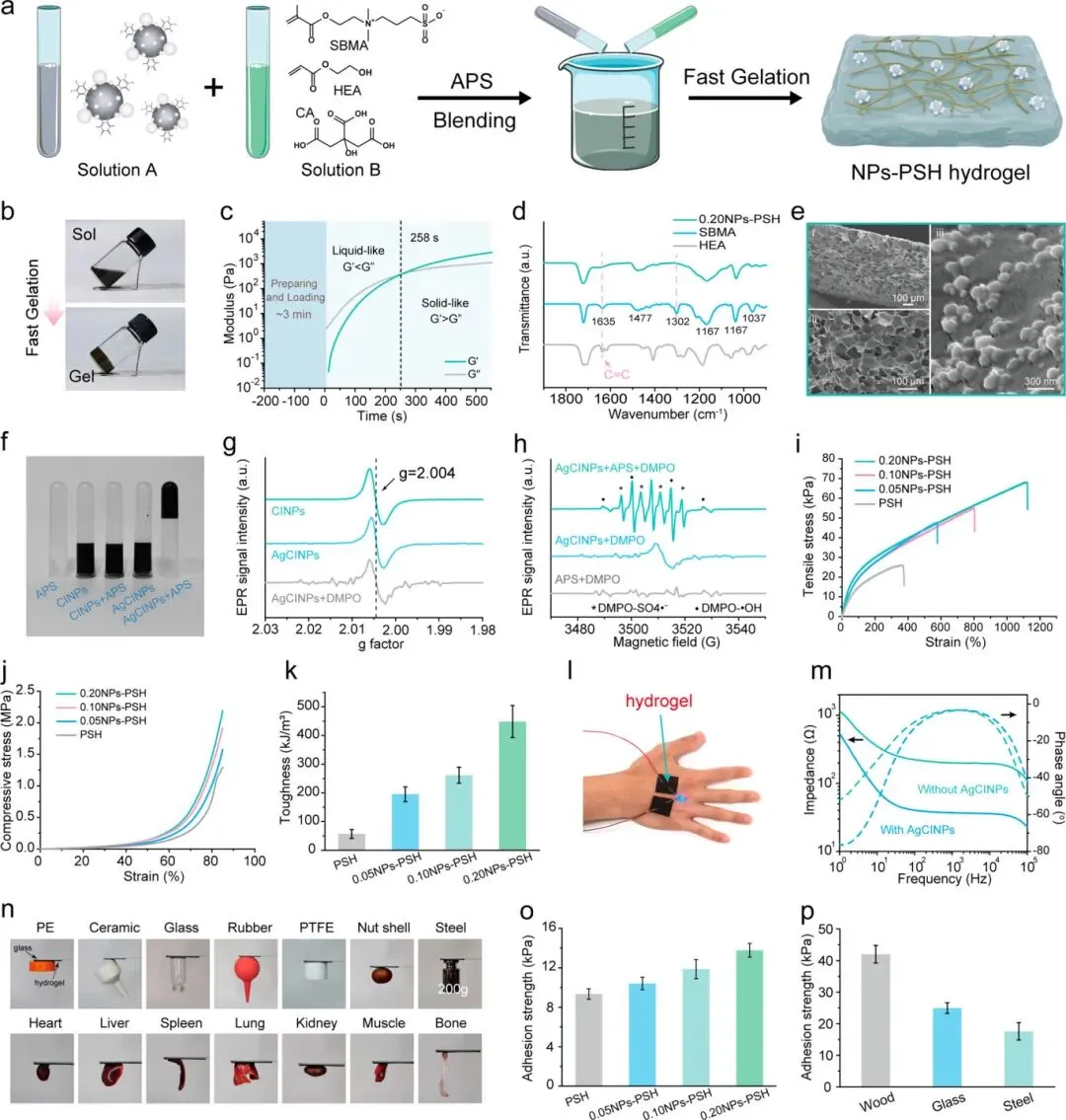
图3. NPs-PSH水凝胶的制备与表征。(a)NPs-PSH水凝胶制备示意图。(b)NPs-PSH水凝胶通过快速溶胶-凝胶转变形成的照片。(c)0.20NPs-PSH水凝胶的流变学测试显示凝胶点。(d)SBMA、HEA和0.20NPs-PSH水凝胶的FTIR光谱。(e)SEM图像显示0.20NPs-PSH水凝胶的多孔结构及其内部的AgCINPs。(f)各种体系凝胶化的照片。(g)CINP和AgCINP溶液的EPR光谱。(h)APS、AgCINP和APS+AgCINP溶液与DMPO的EPR光谱。(i)PSH和NPs-PSH水凝胶的拉伸应力-应变曲线。(j)PSH和NPs-PSH水凝胶的压缩应力-应变曲线。(k)各种NPs-PSH水凝胶的韧性。(l)0.20NPs-PSH水凝胶粘附在手上并连接电路点亮LED灯的照片。(m)PBS浸泡的0.20NPs-PSH水凝胶和PSH水凝胶的电化学阻抗。(n)0.20NPs-PSH水凝胶粘附于各种材料和组织的照片。(o)各种NPs-PSH水凝胶对猪皮肤的粘附强度。(p)0.20NPs-PSH水凝胶对不同基材的粘附强度。
(3)NPs-PSH水凝胶的持久抗氧化性能
NPs-PSH水凝胶的抗氧化性能通过DPPH•、•OH和H₂O₂清除能力评估:0.20NPs-PSH处理后DPPH•在517 nm处特征峰显著降低;ABTS法显示735 nm处吸光度显著降低,表明•OH被消耗;Ti(SO₄)₂比色法显示407 nm处吸光度显著降低,表明H₂O₂被清除;0.20NPs-PSH对三种自由基的清除率均超90%,且清除效率与AgCINPs浓度正相关。氧化微环境中成纤维细胞保护实验显示,与0.20NPs-PSH共培养的细胞绿色荧光显著低于对照组。长期抗氧化能力测试显示,0.20NPs-PSH浸泡于H₂O₂溶液中,每天更换新鲜H₂O₂,第一天407 nm处特征峰显著降低,第七天H₂O₂清除率仍超50%,证实其通过AgCINPs的可逆儿茶酚-醌氧化还原反应维持持久的抗氧化能力。
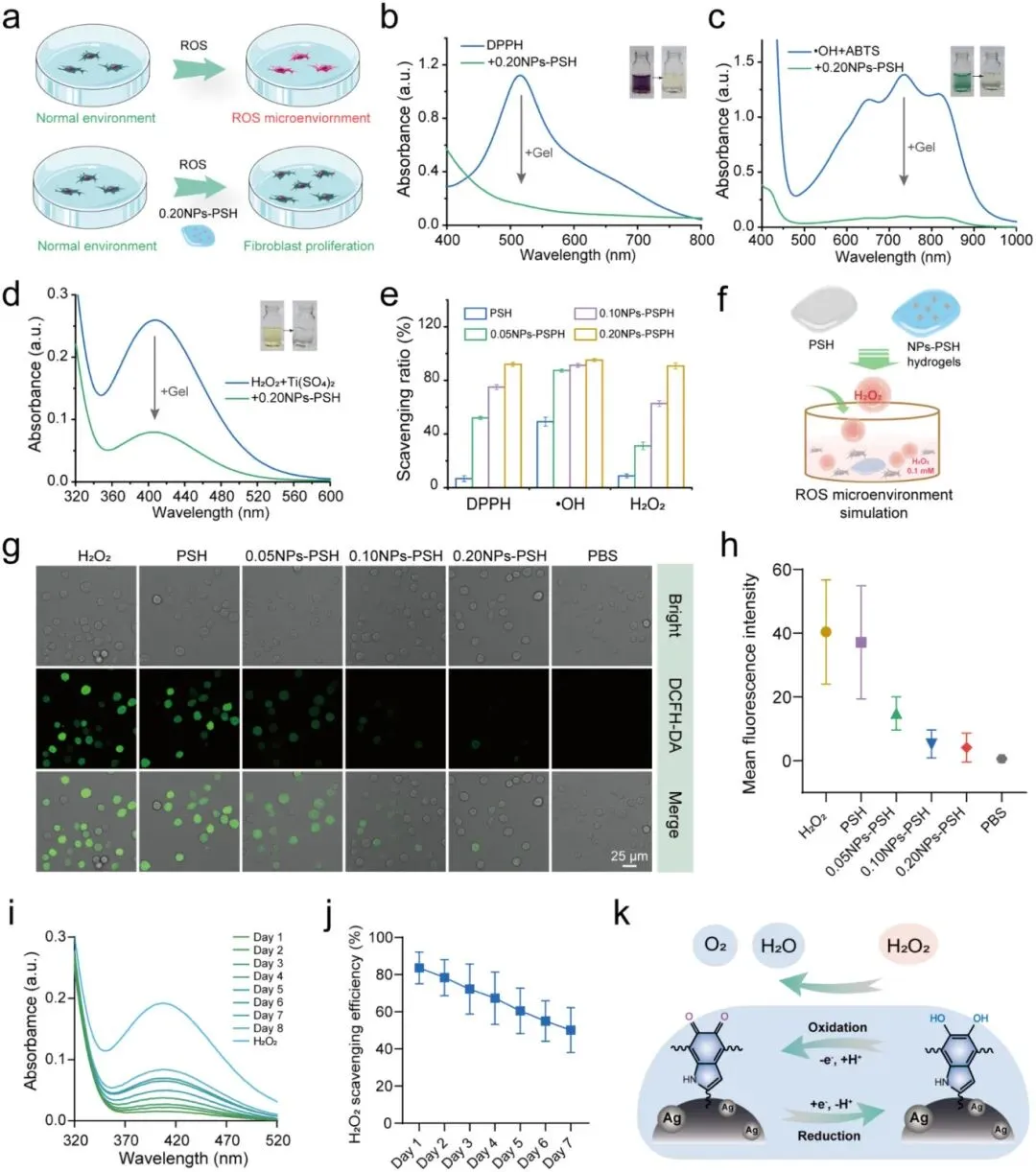
图4. NPs-PSH水凝胶的持久抗氧化性能。(a)NPs-PSH水凝胶缓解氧化应激的示意图。(b)0.20NPs-PSH水凝胶处理前后DPPH•溶液的UV-vis吸光度变化。(c)Fe²⁺/H₂O₂处理后有无0.20NPs-PSH水凝胶的ABTS的Vis-NIR吸光度变化。(d)H₂O₂溶液与有无0.20NPs-PSH水凝胶处理的Ti(SO₄)₂溶液的UV-vis吸光度变化。(e)各种NPs-PSH水凝胶对DPPH•、•OH和H₂O₂的清除效率。(f)NPs-PSH水凝胶在L929细胞中清除氧化应激的测试示意图。(g)各种处理后L929细胞的荧光图像。(h)对应于图g的L929细胞中的平均荧光强度。(i)一段时间内的H₂O₂清除UV-vis吸收光谱。(j)0.20NPs-PSH水凝胶7天内H₂O₂清除效率的变化。(k)0.20NPs-PSH水凝胶持久H₂O₂清除能力的机制示意图。
(4)NPs-PSH水凝胶的持久抗菌性能
NPs-PSH水凝胶对大肠杆菌(E. coli)和金黄色葡萄球菌(S. aureus)的抗菌活性通过平板涂布法、活/死染色和SEM评估:0.20NPs-PSH对S. aureus杀菌率为99.0%,对E. coli为97.7%,SEM显示细菌结构损伤和膜破裂,且可根除生物膜并杀死包裹细菌,对铜绿假单胞菌(P. aeruginosa)和耐甲氧西林金黄色葡萄球菌(MRSA)亦具抗菌活性。体外Ag⁺释放测试显示0.20NPs-PSH可持续释放Ag⁺至少21天,而物理混合的Ag-PSH水凝胶3天后基本停止释放。抑菌圈实验显示0.20NPs-PSH对S. aureus、E. coli、P. aeruginosa和MRSA的抑制分别持续11天、9天、11天和5天,商用敷料仅维持1天;体内实验显示0.20NPs-PSH连续使用10天内有效清除感染伤口中的S. aureus,商用敷料第三天即失效。长期抗菌机制归因于AgCINPs的银-儿茶酚动态氧化还原体系:儿茶酚基团将释放的Ag⁺还原为Ag,减缓释放速率并维持Ag⁺与Ag的动态平衡,同时螯合Ag⁺防止随机释放,实现长效抗菌性能。
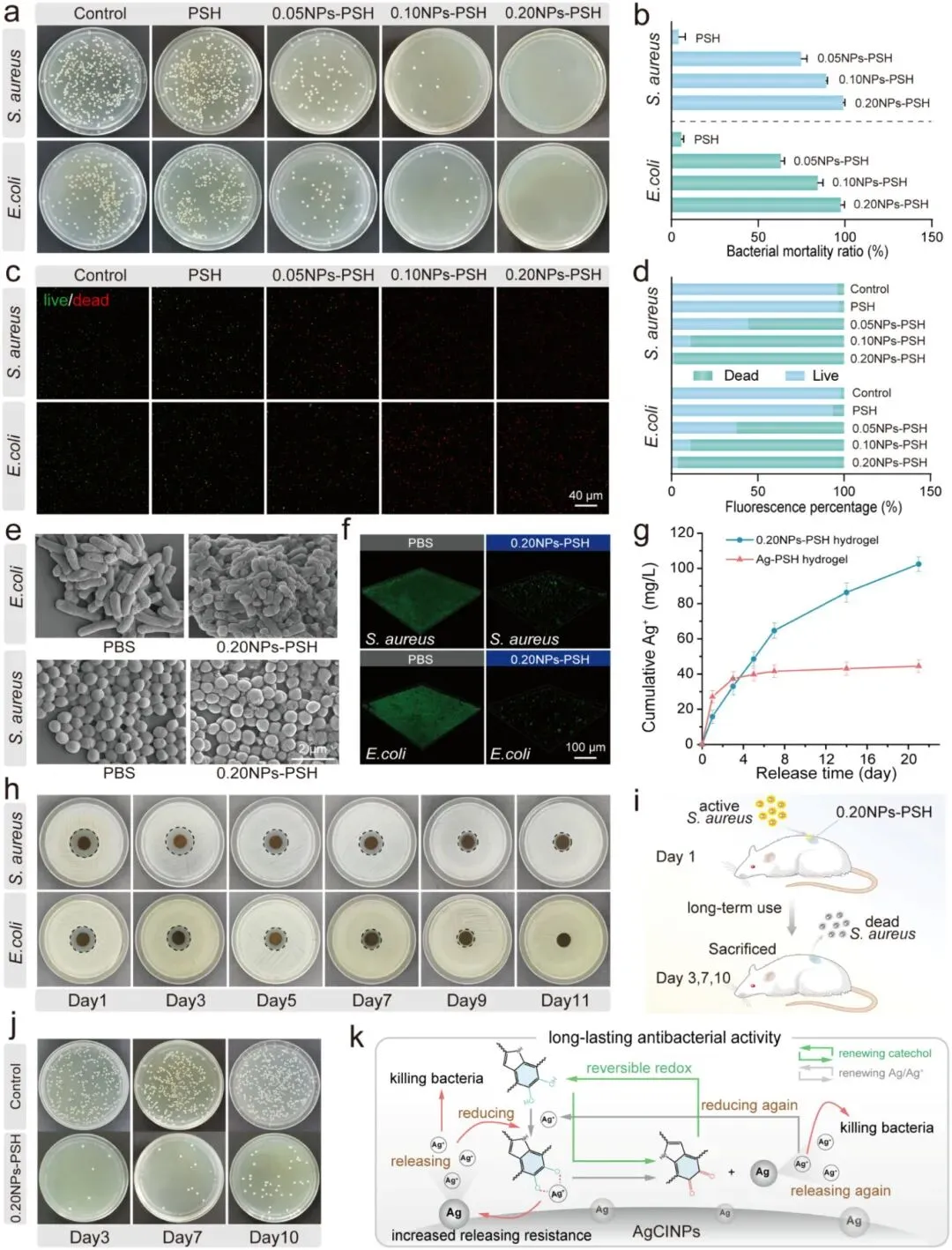
图5. NPs-PSH水凝胶的持久抗菌性能。(a)与PSH和NPs-PSH水凝胶共培养后E. coli和S. aureus形成的细菌菌落照片。(b)对应于图a的抗菌率。(c)显示与PSH和NPs-PSH水凝胶共培养后E. coli和S. aureus活/死细菌的荧光图像。(d)对应于图c的定量分析。(e)与0.20NPs-PSH水凝胶共培养前后细菌的SEM图像。(f)与0.20NPs-PSH水凝胶共培养前后细菌的生物膜。(g)0.20NPs-PSH水凝胶和AgNPs负载水凝胶的Ag⁺释放曲线。(h)0.20NPs-PSH水凝胶对S. aureus和E. coli在11天内的抑菌圈实验照片。(i)体内长效抗菌实验方案示意图。(j)用S. aureus感染伤口并用0.20NPs-PSH水凝胶处理后细菌菌落的照片。(k)NPs-PSH持久抗菌性能机制的示意图。
(5)NPs-PSH水凝胶的生物相容性
0.20NPs-PSH水凝胶的受控Ag⁺释放可有效降低生物毒性。CCK-8实验显示,该水凝胶与L929细胞共培养24、48和72小时后,细胞活力与对照组相当,证实其良好的细胞相容性。皮下植入小鼠后,以聚乳酸(PLA)为对照,H&E染色显示植入物周围组织在1、2、4周的炎症反应及纤维包膜厚度均与PLA组相当;F4/80免疫荧光染色显示两组巨噬细胞数量相近;Masson三色及CD31/α-SMA染色显示4周时两组胶原和血管密度相似。炎症因子分析显示,2周时水凝胶组CCR7、TNF-α、IL-6表达水平低,与PLA组相当,且两组IL-10表达相似。主要器官H&E染色未见明显组织损伤。上述结果表明0.20NPs-PSH水凝胶具有良好的生物相容性。
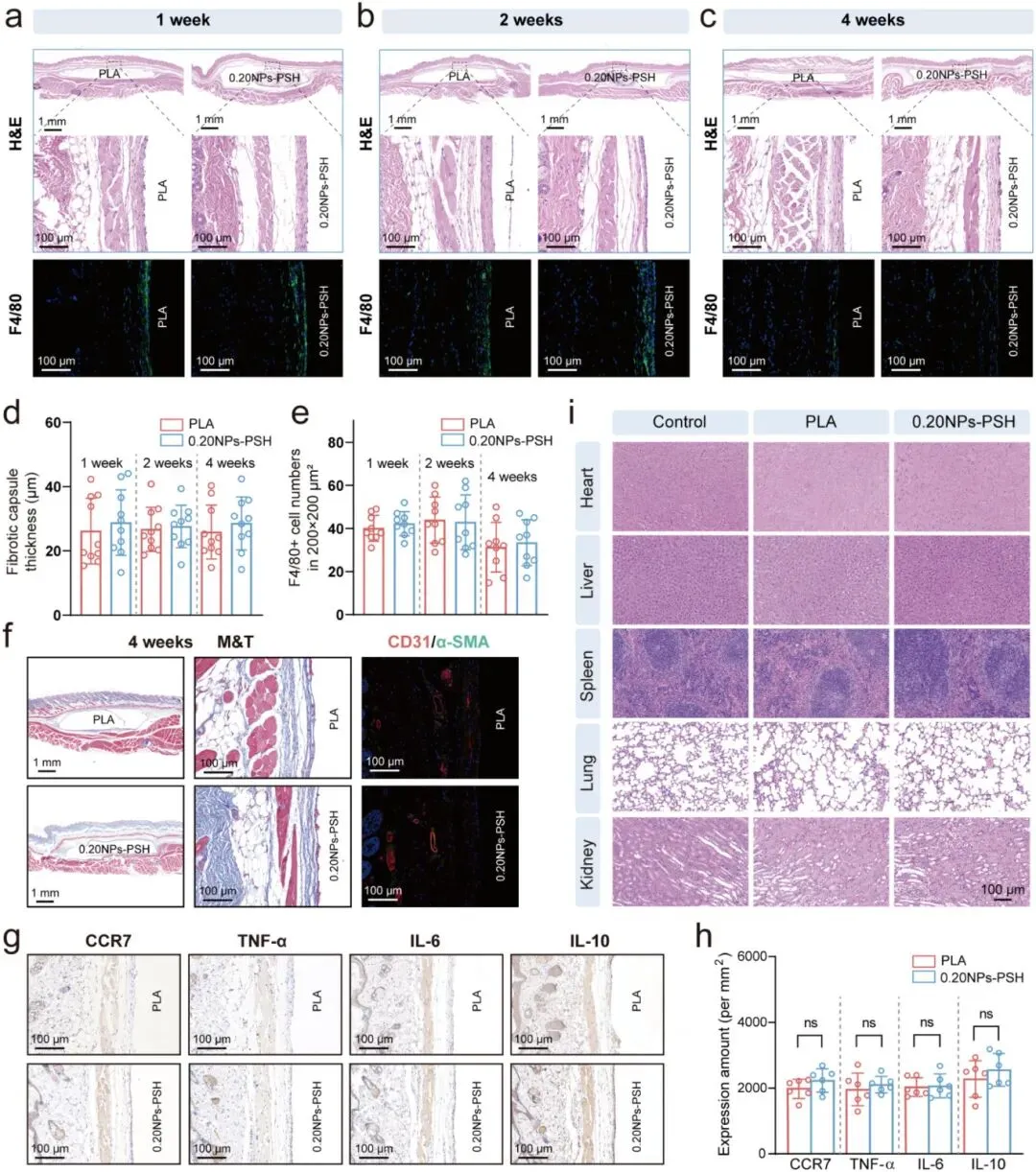
图6. NPs-PSH水凝胶的生物相容性。PLA样品和0.20NPs-PSH水凝胶皮下植入小鼠(a)1周、(b)2周和(c)4周后周围组织的H&E染色和F4/80生物标志物标记。(d)植入1-4周后材料-组织界面的纤维包膜厚度和(e)F4/80密度的定量分析。(f)植入4周后评估胶原包封和血管密度的M&T染色和CD31/α-SMA免疫荧光染色。(g)PLA样品和0.20NPs-PSH水凝胶周围组织中炎症标志物的免疫组织化学染色。(h)炎症标志物表达的定量分析。(i)健康小鼠和材料植入小鼠植入4周后主要器官的H&E染色。
(6)NPs-PSH水凝胶用于糖尿病伤口愈合
在糖尿病大鼠全层伤口模型中评估了NPs-PSH水凝胶单独及联合电刺激(ES)的促愈合效果。实验设置对照组、商用敷料(CD)组、NPs-PSH组、control@ES组、CD@ES组和NPs-PSH@ES组,换药频率为7天。第14天伤口闭合率显示,NPs-PSH组(90±3%)和NPs-PSH@ES组(96±2%)显著高于对照组(73±4%)、CD组(76±3%)、control@ES组(86±2%)和CD@ES组(87±3%),且ES组愈合速度均快于非ES组。组织学分析显示,NPs-PSH组肉芽组织厚度(1556±110 μm)在非ES组中最高,NPs-PSH@ES组(1776±223 μm)在ES组中最高;NPs-PSH组和NPs-PSH@ES组的胶原体积分数(58±8%和82±4%)显著高于对照组(16±3%)。免疫染色结果显示,NPs-PSH组上皮层厚度(63±8 μm)低于对照组(106±11 μm)和CD组(103±7 μm),毛囊数量(17±2个/视野)显著增加;ES使再上皮化平均增加1.2倍。NPs-PSH@ES组血管密度(24±4个/视野)最高,高于对照组(7±2个/视野)和NPs-PSH组(20±3个/视野)。NPs-PSH组和NPs-PSH@ES组M2巨噬细胞比例(3.3±0.1%和4.6±0.2%)高于对照组(0.4±0.2%),TNF-α表达降低而IL-10表达增加,NPs-PSH@ES组变化更显著。转录组分析显示,与对照组相比,NPs-PSH组有2124个差异表达基因(DEGs),NPs-PSH@ES组有3499个DEGs;GO富集分析表明DEGs主要涉及细胞外基质组织、表皮发育、血管生成和炎症反应调节,NPs-PSH@ES组富集因子更强;NPs-PSH@ES组在细胞迁移调节和胶原纤维组织方面富集更显著。特定基因分析显示,NPs-PSH和NPs-PSH@ES组伤口愈合相关基因(Veg、Dhcr24等)上调,炎症相关基因(Tlr2、Nlrp3等)下调,NPs-PSH@ES组变化更明显。GSEA和KEGG分析显示NPs-PSH和NPs-PSH@ES组NOD样受体、IL-17和TNF信号通路下调。上述结果表明NPs-PSH通过促进上皮化、血管生成和抑制炎症加速糖尿病伤口愈合,联合ES可进一步增强细胞迁移和皮肤发育。
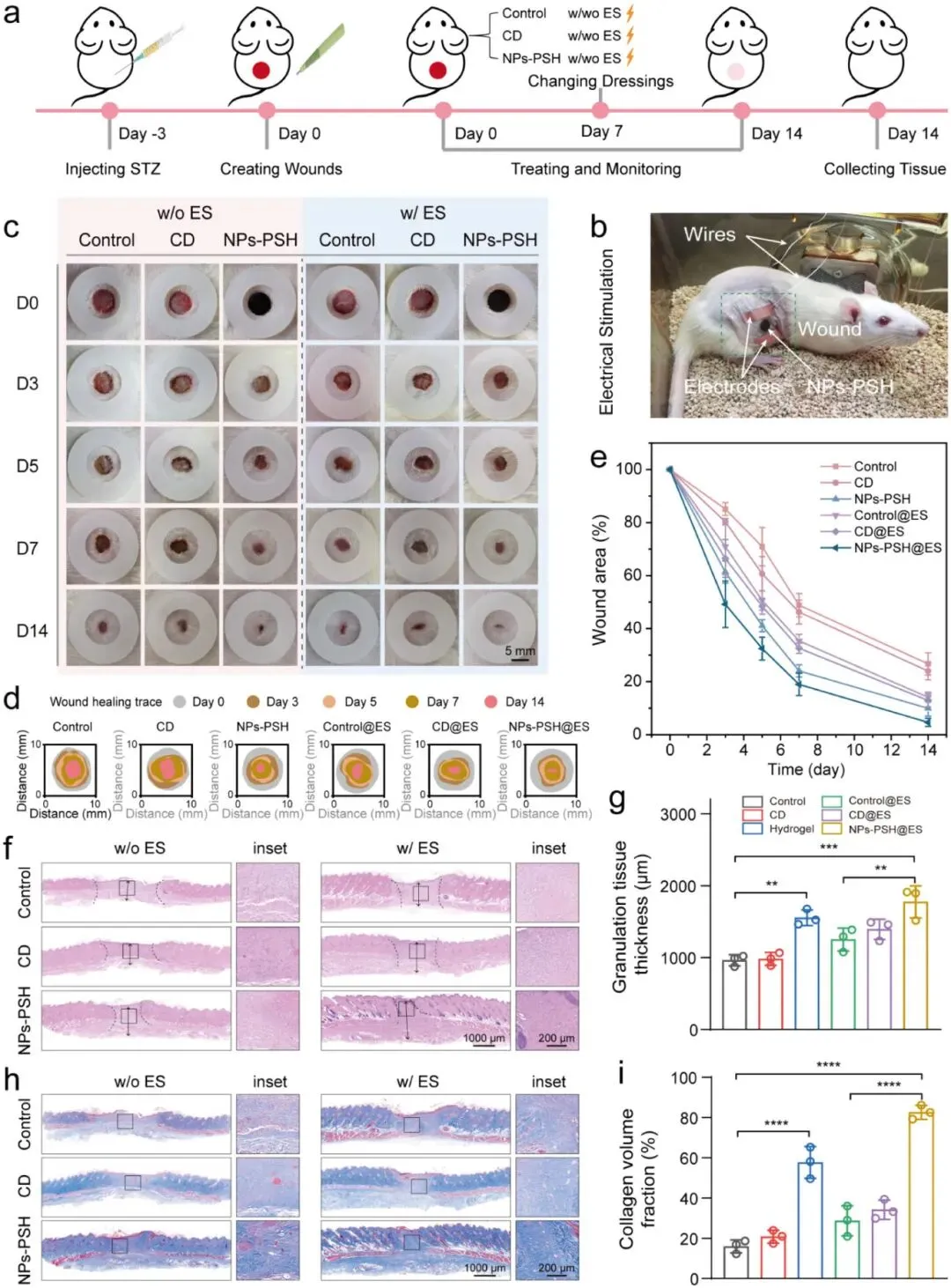
图7. NPs-PSH及其与ES联合对糖尿病大鼠伤口愈合效果的评价。(a)动物实验时间线示意图。(b)NPs-PSH处理糖尿病伤口在ES下的实验装置照片。(c)不同治疗组伤口的代表性照片。(d)不同组的伤口愈合痕迹。(e)不同治疗后伤口面积的定量分析。(f)第14天收集的皮肤组织的H&E染色图像。(g)肉芽组织厚度的定量分析。(h)第14天收集的皮肤组织的M&T染色图像。(i)胶原密度的定量分析。
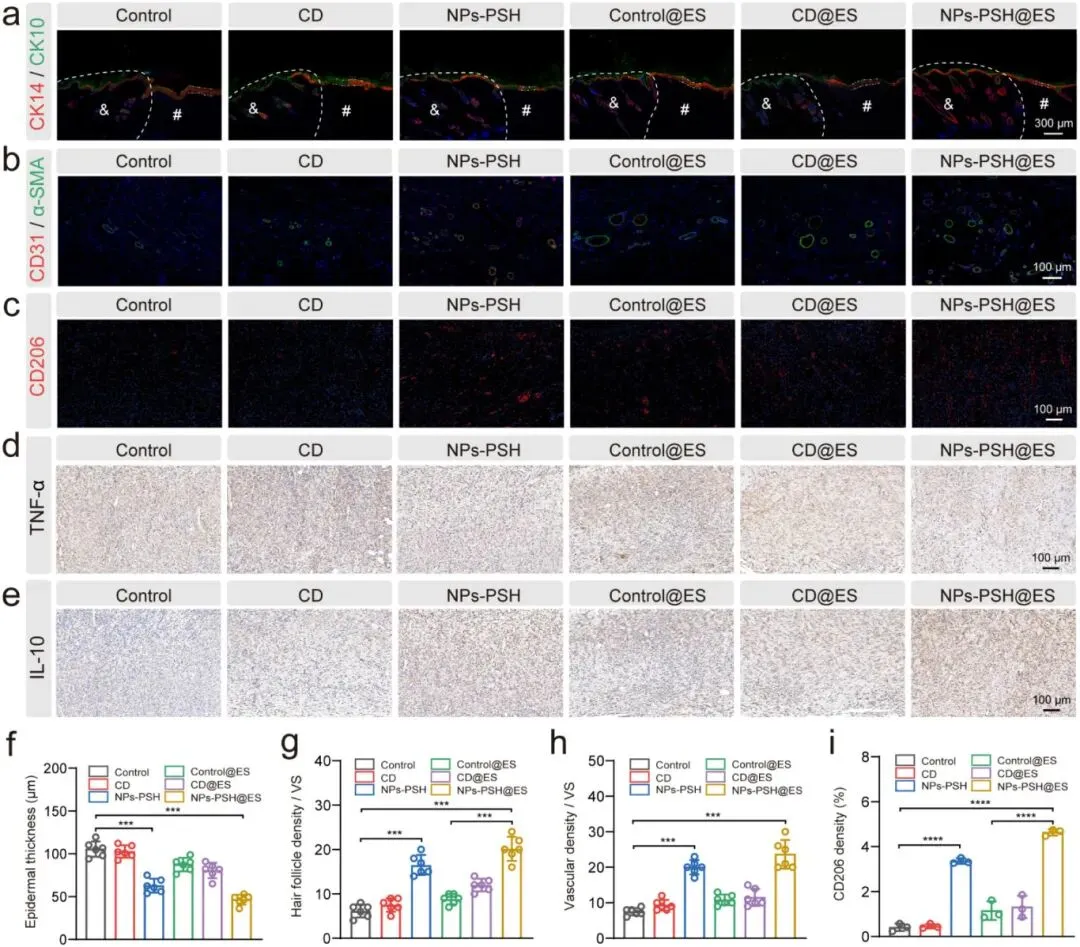
图8. 伤口组织的免疫组织学和定量分析。(a)上皮层的CK14/CK10免疫荧光染色。(b)用CD31和α-SMA染色的血管结构。(c)伤口区域组织切片的CD206免疫荧光染色。(d、e)第7天不同组再生皮肤中TNF-α(d)和IL-10(e)的免疫组织化学染色图像。(f)不同治疗后再生伤口中表皮厚度、(g)毛囊、(h)血管和(i)CD206的定量分析。
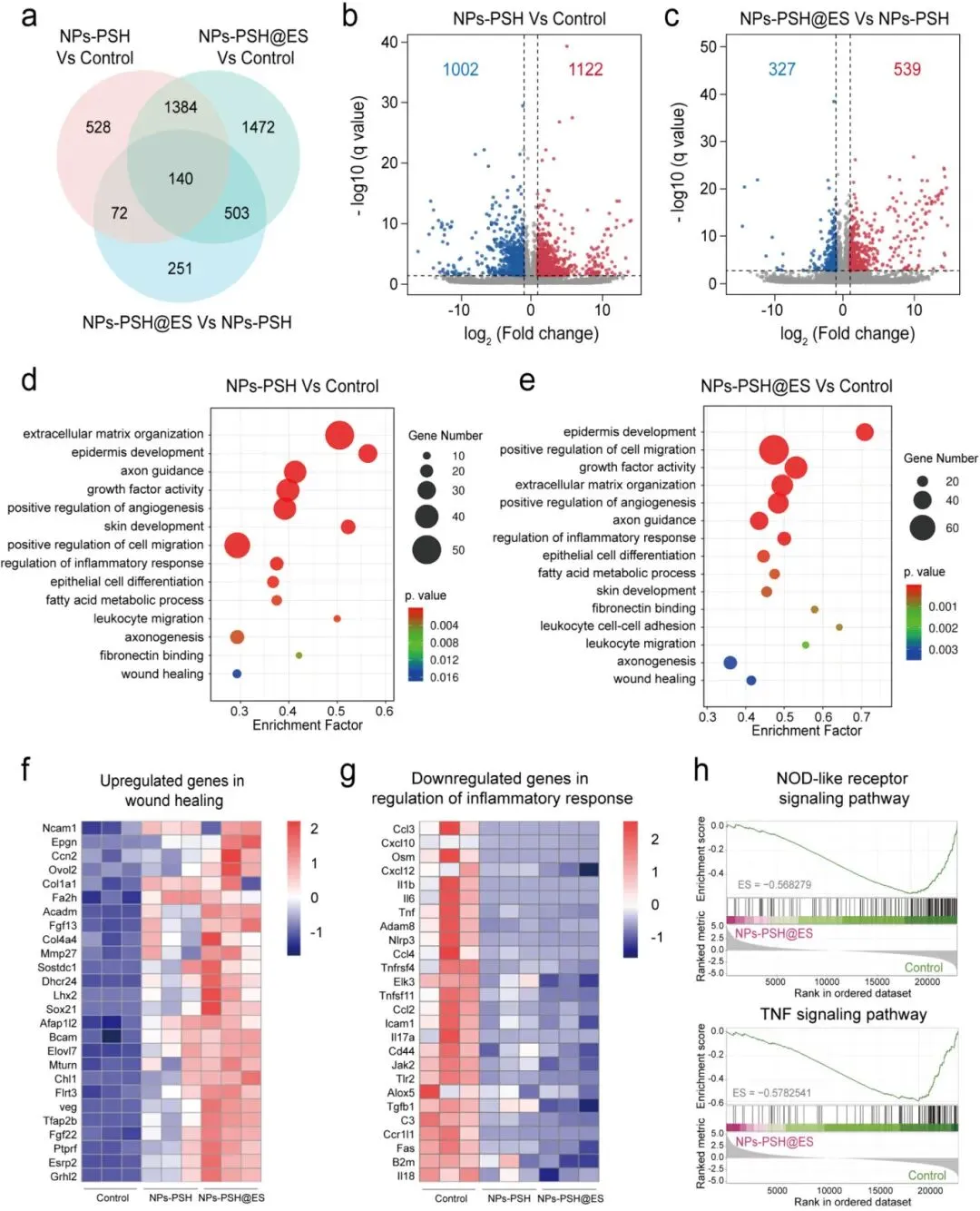
图9. NPs-PSH和NPs-PSH@ES处理后伤口组织的转录组分析。(a)不同治疗组差异基因的Venn图(n=3)。(b)NPs-PSH水凝胶处理后鉴定上调和下调基因的火山图。(c)NPs-PSH@ES处理后鉴定上调和下调基因的火山图。(d)NPs-PSH处理的GO富集分析。(e)NPs-PSH@ES处理的GO富集分析。(f)伤口愈合中显著上调基因的热图。(g)炎症反应调节中显著下调基因的热图。(h)NOD样受体和TNF信号通路基因集的GSEA。
本研究开发了基于银-儿茶酚纳米颗粒(AgCINPs)的长效水凝胶敷料(NPs-PSH),通过构建银-儿茶酚动态氧化还原体系,实现了抗氧化儿茶酚基团的持续再生与Ag⁺的长效缓释。该敷料在保持低生物毒性的同时,兼具优异的抗菌(≥11天)、抗氧化(7天后H₂O₂清除率>50%)、生物粘附性(14.21 kPa)、导电性(0.42 S m⁻¹)及机械韧性(506.15 kJ m⁻³)。糖尿病大鼠模型证实其在7天佩戴周期内可有效促进伤口愈合并减少换药频率,展现出与经皮电刺激的协同应用潜力,为慢性伤口管理提供了高效可持续的新策略。
原文链接:
https://doi.org/10.1021/acsnano.5c04690
点击文末左下角 “阅读原文”可快速跳转至原文文献
👇点击关注公众号,获取更多学术前沿👇
IF:16.1《ACS Nano》华东师范大学徐志爱团队:靶向脑部的金属有机框架纳米平台重编程胶质母细胞瘤的铁死亡敏感性
IF:14.1 《Adv. Sci.》南加州大学Chen Jianfu教授团队:空间转录组学揭示颞下颌关节炎疼痛的成纤维细胞-免疫微环境重塑机制
IF:7.3《Cell子刊》复旦大学梁子骐、吴海苗,海军大徐辰、刘洋:钛种植体表面硅烷改性实现骨整合与抗菌性能的协同提升
👉 联系我们


地址:广州市黄埔区掬泉路3号广州国际企业孵化器A栋702房
电话:020-3202 9909
官网:www.chuangseed.com

